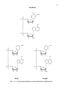Содержание к диссертации
Введение
Глава 1. ЛИТЕРАТУРНЫЙ ОБЗОР 9
1.1. Структура и основные физико-химические свойства никотинамидных коферментов 9
1.2. Распространение никотинамидных коферментов в животных тканях 17
1.3. Области применения никотинамидных коферментов 21
1.4. Способы получения никотинамидных коферментов 24
1.5. Выделение и очистка никотинамидных коферментов 36
Глава 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ 40
2.1. Объект исследования 40
2.2. Реагенты 40
2.3. Методы анализа ... 41
2.3.1. Методика определения концентрации НАД+ в растворах и конечном продукте 41
2.3.2. Методика определения восстановленных форм никотинамидных коферментов НАДН и НАДРН 42
2.3.3. Определение концентрации нуклеиновых компонентов в растворах и содержания нуклеиновых компонентов в готовом продукте 42
2.3.6. Методика определения хлоридов в растворе 45
2.3.7. Определение концентрации соляной кислоты в растворе 45
2.3.8. Определение содержание аминокислот методом хроматофафии на
бумаге 45
2.4. Методы исследования 46
2.4.1 Методика проведения экстракции нуклеиновых кислот и никотина-
мидадениндинуклеотидых коферментов из биомассы пекарских дрож
жей 46
2.4.2. Методика проведения ультрафильтрации 46
2.4.3. Методика выделения никотинамидных коферментов ионным обменом 48
2.4.4. Методика выпаривания 49
2.4.5. Методика осаждения 49
Глава 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ И ОБСУЖДЕНИЕ РЕЗУЛЬ ТАТОВ 50
3.1. Экстракция никотинамидных коферментов из клеток хлебопекарских дрожжей водными растворами. Количественные закономерности процесса 50
3.2. Очистка НАД+ содержащих экстрактов ультрафильтрацией. Количественные закономерности процесса 67
3.3. Выделение и очистка НАД+методом ионного обмена 77
3.4. Кристаллизация НАД+ из водно-спиртовых растворов 97
3.5. Разработка стадии утилизации отходов, образующихся в производстве НАД из биомассы хлебопекарских дрожжей 114
ВЫВОДЫ 119
ЛИТЕРАТУРА 120
- Структура и основные физико-химические свойства никотинамидных коферментов
- Определение концентрации нуклеиновых компонентов в растворах и содержания нуклеиновых компонентов в готовом продукте
- Экстракция никотинамидных коферментов из клеток хлебопекарских дрожжей водными растворами. Количественные закономерности процесса
Введение к работе
Актуальность темы. Никотинамидадениндинуклеотид (НАД+) является одним из важнейших коферментов, ответственных за окислительно-восстановительные процессы в клетках. НАД+ используется в медицине, как иммуномодулятор. Он обеспечивает нейротрансмиттерную функцию - передачу нервных импульсов между мозгом и остальными органами тела. Нарушение синтеза некоторых гормонов, например, интерферона, также может быть вызвано недостатком НАД+. Никотинамидные коферменты являются антиоксидантами, защищают организм от свободных радикалов, токсинов, канцерогенов, загрязнений окружающей среды и изменений в процессе старения. Кроме того, НАДН защищает печень от алкоголя, предотвращая образование алко-гольиндуцированного ингибитора - тестостерона. Он также нормализует уровень холестерина и кровяного давления. НАД+ входит в состав лекарственных препаратов, используемых для лечения болезней связанных с нарушением деятельности центральной нервной системы, таких как болезни Паркинсона и Альцгеймера. Также препараты содержащие НАД+ используют в медицине при лечении заболеваний сердца, желудка и печени. Например, препарат «Энерго-стим», содержащий НАД+, цитохром С и инозин, применяли в терапии животных страдающих токсико-аллергическим миокардом.
В настоящее время НАД+ за рубежом получают микробиологическим и химическим синтезом. Химический синтез является многостадийным процессом с применением дорогостоящих реагентов. В России производство НАД+ в настоящее время отсутствует. Сегодня в мире развиты крупнотоннажные биотехнологические производства, в которых отходом является микробная биомасса, которая может являться потенциальным источником НАД+. В литературе приводится описание методов выделения НАД+ из микробной биомассы, которые не используются в промышленности из-за сложности масштабирования процесса и применения дорогостоящих и труднодоступных реагентов. Для промышленного получения НАД+ наиболее перспективным сырьем являются хлебопекарские дрожжи Saccharomyces cerevisiae, которые выпускаются про-
мышленностыо в больших объемах, а также образуются в значительных количествах в качестве отходов спиртового производства. Так как содержание НАД+ в биомассе дрожжей не превышает 0,3% от воздушно сухих веществ (СВ), организация такого сопутствующего производства не позволит снизить количества образующегося твердого отхода, хотя и повысит рентабельность основного производства.
Поэтому представляется актуальной разработка технологии выделения НАД+ из биомассы хлебопекарских дрожжей с применением дешевых и доступных реагентов (растворы минеральных кислот, солей и щелочей) и технологических операций, которые могут быть реализованы в промышленных условиях с утилизацией образующихся твердых и жидких отходов.
Целью работы явилась разработка малоотходной технологии получения очищенного препарата НАД+ из нативной биомассы хлебопекарских дрожжей.
В задачи данной работы входило: создание научных основ с целью совершенствования технологического процесса получения НАД+ из биомассы хлебопекарских дрожжей включающего экстракцию водными растворами, ультрафильтрацию, одностадийный ионный обмен, осаждение из водно-спиртовых растворов, разработка кинетических схем для создания алгоритма управления технологическим процессом и определить пути утилизации отходов, образующихся в основном производстве, для получения на их основе продуктов нуклеотидной, белковой и углеводной природы технического назначения.
Научная новизна: Впервые показана возможность получения очищенного препарата НАД+ из биомассы хлебопекарских дрожжей с применением стадии ультрафильтрации для очистки от высокомолекулярных примесей, одностадийного ионного обмена на катионите, кристаллизации из водно-спиртового раствора.
Показана принципиальная возможность получения НАД+ из биомассы других дрожжей (p. Candida, Torula) по предлагаемой технологии.
Впервые показана возможность применения миндальной кислоты в качестве ингибитора нуклеаз на стадии экстракции НАД+, что позволило упростить процесс очистки конечного продукта от примесей нуклеотидной природы.
Проведено количественное изучение стадий экстракции НАД+, ультрафильтрации, ионного обмена, кристаллизации из водно-спиртовых растворов, как основы для создания алгоритма управления технологическим процессом получения НАД+.
Практическая значимость: Разработаны основы технологии получения очищенного препарата НАД+ (с содержанием основного вещества не менее 95%) из нативной биомассы хлебопекарских дрожжей. Предложены алгоритмы управления стадиями экстракции НАД+ из биомассы дрожжей, ультрафильтрации, ионного обмена и кристаллизации.
Апробация работы. Материалы диссертации докладывались на: 3-ем Международном Конгрессе «Биотехнология: состояние и перспективы развития» (Москва, март 2005 г); Международных конференциях «Успехи в химии и химической технологии» (РХТУ имени Д. И. Менделеева, Москва, ноябрь 2004 г, ноябрь 2005 г).
Публикации. По теме диссертации опубликовано 4 статьи и двое тезисных сообщения в материалах научных конференций.
Структура и объем работы: диссертация состоит из Введения, Обзора литературы, Описания методик проведения экспериментов и анализов, 5-ти глав экспериментальной части, включающей описание результатов и их обсуждение, Заключения, Выводов, Списка литературы (115 наименований, в том числе J00 на иностранных языках) и 4 приложений. Работа изложена на 165 стр. машинописного текста и содержит 60 таблиц, 64 рисунков.
8 СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ. НАД-никотинамидадениндинуклеотид НАДН -никотинамидадениндинуклеотид восстановленный НАДФ - никотинамидадениндинуклеотид фосфат НАДФ-Н2 - никотинамидадениндинуклеотид фосфат восстановленный СВ-сухие вещества СП-сырой протеин БК-белковые компоненты НК-нуклеиновые компоненты УВ-углеводы
БАВ-биологически активные вещества ПАВ - поверхностно-активные вещества АМФ - аденозин монофосфат
9 1. ЛИТЕРАТУРЫЙ ОБЗОР
При разработке основ технологии получения никотинамидных кофермен-тов необходимо, прежде всего, знать химические свойства выделяемых веществ, чтобы подобрать условия проведения технологических стадий. Поэтому рассмотрим результаты последних исследований физико-химических свойств никотинамидных коферментов.
/./. Структура и основные физико-химические свойства никотинамидных коферментов.
К пиридиновым или никотинамидным коферментам относятся нуклеоти-ды, содержащие в качестве каталитически активной группировки амид никотиновой кислоты. Основными представителями этой группы ферментов являются два нуклеотида, которые обозначаются рациональными названными: никоти-намидадениндинуклеотид (НАД+) и никотинамидадениндинуклеотид фосфат (НАДФ+). Химическая структура обоих нуклеотидов представлена на рис. 1.1.1.
Никотинамидные коферменты по своему строению являются фосфатами (3-N-рибофуранозидов замещенного пиридиния; в 5'-положении они содержат пиро-фосфатную группировку. Различаются эти два кофермента лишь строением группировки, присоединенной ко второму остатку фосфорной кислоты. В молекуле НАД+ этот остаток аденозина, а в НАДФ+ - остаток аденозин-2'-фосфорной кислоты [1]. Молекула НАД+ состоит из двух гетероциклов - пиридинового и аденино-вого, соединенных цепочкой из двух остатков рибозы и остатка пирофосфорной кислоты.
Активной частью молекулы является никотинамидное кольцо, участвующее в окислительно-восстановительных реакциях и в реакциях присоединения нуклеофильных агентов. Восстановление его с помощью дитионита натрия, а также субстратами в реакциях, катализируемых ферментами, приводит к образованию НАДН - 1,4-дигидроникотинамидадениндинуклеотида [2].
10 В растворе НАД+ проявляет свойства слабой кислоты. Было выполнено потен-
циометрическое титрование НАД+ гидроксидом натрия при различной ионной силе раствора [3]. Методом экстраполяции к нулевой ионной силе была найдена термодинамическая величина рКа, значение которой составило 3,88±0,02. В молекуле НАД+ заряд пиридиниевого катиона компенсируется отрицательным зарядом одной из фосфатных групп. Природа группы, ионизация которой обнаруживается в растворе, точно не установлена. Согласно исследованиям спектров ПМР, скорее всего это может быть ароматический атом Nt адепинового кольца [4, 5]. Характерным свойством никотинамидных коферментов являются их спектры поглощения в ультрафиолетовой области спектра. НАД+ и НАДФ+ характеризуются полосой поглощения с максимумом при 260 нм. У восстановленных форм (НАД-Н2 и НАДФ-Н2) появляется новая полоса поглощения с максимумом при 340 /ш; возбуждение НАД-Н2 и НАДФ-Н2 излучением с этой длиной волны вызывает флуоресценцию с \шс при 480 нм. Спектрофотометрические и спек-трофлуорметрические методы, основанные на этих свойствах, применяются для аналитического определения никотинамидных коферментов и для измерения связанных с ними дегидрогеназ (рис. 1.1.2). [1].
Как положение максимума, так и интенсивность поглощения этой полосы может меняться в зависимости от полярности среды, что определяется относительным структурным вкладом хиноидной формы НАДН, несущей положительный и отрицательный заряды, соответственно на атоме азота пиридинового кольца и атоме кислорода карбоксамидной группы.
НАДФ-Н2
н н
CONH,
,0,
н н.
-О Р О СН
н | | н
он н
/
NH,
о,
н н.
-о—Р—о—сн2
н | | н
ОН ОР03Н2
^N/
Н | | н
он он
C0N4
Э С4
Н | | н
он н
//
-О СНг
,0.
.Н Н.
Н | | Н
ОН 0PQH2
^C0N4
NH>
^>
НАД+ НАДФ+
Рис. 1.1.1. Структурные формулы никотинамидных коферментов.
Спектр возбуждения флюоресценции НАДН имеет два максимума: при 340 нм — за счет поглощения никотиамидного кольца и при 260 нм - в области, где 80— 90% энергии поглощает пуриновая часть молекулы [6], что объясняется внутримолекулярным переносом энергии с пурино-вой части на дигидроникотинамидную [7].
X [nm]
Рис. 1.1.2. Спектры поглощения никотинамидных коферментов.
Окисленные и восстановленные формы никотинамидных коферментов отличаются друг от друга и по своим химическим свойствам. Так, НАД' и НАДФ относительно устойчивы в разбавленных кислотах и разрушаются слабыми щелочами, а восстановленные формы, наоборот нестойки в кислой среде и сравнительно устойчивы в слабощелочной. Эти свойства используются при раздельном определении окисленных и восстановленных форм никотинамидных коферментов. В кислой среде восстановленные формы быстро утрачивают характерный для них пик поглощения при 340 нм и превращаются в соединения с максимумом поглощения 290 нм. При изучении характера превращений и природы соединений, образующихся при взаимодействии восстановленных никотинамидных нуклеотидов с кислотами, было установлено, что происходит разрыв связи между атомом N и шестым атомом С в кольце пиридина. При сильнокислой реакции среды (рН 1,0) расщеплению подвергается также связь между гетероциклическим атомом азота и остатком рибо-зы, в результате чего молекула НАД-Н2 распадается на аденозиндифосфатри-бозу и соединение, содержащее группировку H2N—С=С—СО—, ответственную за поглощение при 290 нм. Соединения это типа, образование которых доказано в физиологических условиях, могут принимать участие в окислительном фос-форилировании на уровне НАД-Hi. При взаимодействии со щелочью окисленные формы НАД' и НАДФ' быстро образуют комплексы с ионом ОН", характе-
13 ризующиеся максимумом поглощения при 280-290 нм. [1]. Эта реакция обратима, и при нейтрализации раствора указанные комплексы легко превращаются в исходные соединения. В ходе дальнейшей реакции со щелочью комплексы, поглощающие при 280-290 нм, довольно быстро превращаются в соединения, характеризующиеся максимумом поглощения в области 340-360 нм.
Параллельно с описанными превращениями окисленные формы нуклео-тидов в щелочной среде частично подвергаются омылению с превращением амидной группы в карбоксильную [1].
В кислых растворах восстановленные коферменты легко разрушаются, скорость окисления зависит от рН среды. При 23 С в 0,02 н растворах НС1 99 % НАДН разрушается за 0,6 минуты, а при рН 7 - только 0,2 % за час.
В щелочных условиях восстановленные коферменты очень стабильны. Установлено, что нагревание в течении одного часа при 100 С в 0,1 н NaOH не приводит к разрушению восстановленных коферментов. Оптимальные значения рН, при которых восстановленные коферменты наиболее устойчивы, лежат в пределах от 9 до 11.
Окисленные никотинамидные коферменты не устойчивы в щелочных условиях, т. к. щелочь способствует их деструкции. Скорость деструкции возрастает также под действием солей - NaCl, Na2S04, NaiHPO,*. Скорость деструкции составляет 11 % / С в интервале температур от 60-100С, при рН 8-11. [8].
В вопросе о конформации НАД+ и НАДН следует выделить две стороны (в порядке важности и сложности): 1) конформация НАД+ в растворе и 2) конформация НАД+ в фермент-коферментном комплексе. Строгая ориентация в пространстве отдельных частей молекулы динуклеотида необходима для вполне определенного расположения никотинамидного кольца относительно функциональных групп фермента, а также молекулы субстрата. Малейшее изменение углов валентных связей или межатомных расстояний в молекуле ко-фермента должно приводить к нарушению уникальной согласованности и эффективности каталитического процесса. Вследствие комплементарное молекулы кофермента участку связывания поверхности фермента (кофермент явля-
14 ется «слепком» с участка связывания) изучение структуры НАД+ в фермент-коферментном комплексе дает непосредственную информацию о пространственном расположении функциональных групп активного центра фермента, взаимодействующих с коферментом. [2]
Одним из важных направлений в изучении механизма действия ферментов является расшифровка механизма конгруентной модельной реакции. Для НАД-зависимых дегидрогеназ неизвестны в настоящее время такие реакции. Описаны, однако, реакции, в которых НАД+ и НАДН выступают в роли окислителя или восстановителя [9-11]. НАД+ является полифункциональной молекулой, содержащей катионные и анионные группы. Остатки рибозы и пирофос-фатная группа сообщают ей ярко выраженный полярный характер, в то время как пиридиновый и пуриновый циклы гидрофобны. Вследствие такого многообразия свойств молекула НАД+ взаимодействует не только с большим числом апоферментов, но и с различными низкомолекулярными соединениями.
Восстановленная форма НАД+, как и многие дегидропиридины, является энергичным восстановителем. Для восстановления никотинамидного кольца в модельных системах отсутствует необходимость во всей остальной части молекулы НАД+ . Так, описан нестереоспецифический обмен водорода в системе 1-пропилникотинамид-1-пропил-1,4-дигидроникотинамид [12] и восстановление гексахлорацетона под действием 1 -бензил- 1,4-дигидроникотинамида [13].
Скорость, с которой тот или иной 1,4-дигидропиридин окисляется 2,6-дихлорфенолиндофенолом, обратно пропорциональна «сродству» соответствующего пиридина к CN" . Валленфелс сделал из этого вывод, что водород переносится в реакции окисления — восстановления в виде гидрид-иона [14].
Двухлористая ртуть образует с 3-ацетилпиридинадениндинуклеотидом комплекс, обнаруживаемый по появлению ультрафиолетового спектра, отличного от спектра исходного динуклеотида [15].
Недавно были опубликованы данные, описывающие взаимодействие НАДН и Fe3+, при котором образуется комплекс, окрашенный в голубой цвет, и происходит окисление НАДН и восстановление Fe3+ [16]. В образовании ком-
15 плекса принимают, по-видимому, участие атомы азота гетероциклов. НАДН легко окисляется кислородом воздуха, находясь в связанном состоянии с ферментами [17,18]. При этом образуется перекись водорода. В присутствии 4-амино-2,6 - дийодфенола НАДН стехиометрически окисляется молекулярным кислородом [19].
По данным Байте с сотрудниками, глутаматдегидрогеназа катализирует с участием НАДН образование тринитробензола из тринитробензолсульфакислоты [20]. Реакция стереоспецифична и является совершенно необычной для НАДН.
Адениновое кольцо, остатки рибозы и пирофосфат влияют на реакцион
ную способность никотинамидного кольца в НАД+. Так, эфирная группа в этил-
никотинатадениндинуклеотиде гидролизуется существенно медленнее, чем в эти
ловом эфире 1-метилникотиновой кислоты. При действии перманганата калия в
нейтральном растворе никотинамидное кольцо в 2,3-
дидезоксиникотинамидмононуклеотиде окисляется значительно труднее, чем в природном никотинамидмононуклеотиде [21].
Способность никотинамидного кольца НАД+ присоединять по 4-углеродному атому различные нуклеофильные агенты, такие, как пируват, диок-сиацетон, меркаптаны, гидроксиламин, ноны CN", S03 " и S2O4" является чрезвычайно важной.
Величина константы диссоциации полученных соединений позволяет оценить электрофильность молекулы и предсказать поведение ее в различных системах.
Каплан с сотрудниками был предложен спектрофотометрический метод определения НАД+, основанный на образовании аддукта НАД-CN", имеющего спектр с характеристической полосой поглощения при 325 нм. Было показано, что никотинамид, N-метилникотиновая кислота и НАД-Н2 не реагируют с CN", что указывает на важную роль одновременно карбоксамидной группы и положительно заряженного атома азота пиридиниевого кольца в способности Сд
16 атома присоединять нуклеофильный агент. Аддукты Ы-метилникотинамид-СЫ' и НАД-CN' имели практически идентичный спектр [22].
Продукт присоединения сульфита к НАД+ был обнаружен спектрофото-метрически еще в 1938 г [23]. Он обладает значительной величиной поглощения при 329 нм и обнаруживается даже в разбавленных растворах: 2-10"4М сульфита натрия и 5Т0'5М НАД. При большем разведении комплекс почти полностью диссоциирует на исходные компоненты. Коэффициент молярной экстинкции С м 320 им - 71 000 [24]. Аддукт сульфит-НАД аналогичен по структуре аддукту CN-НАД, НАДН и является, вероятно, соединением, в котором сульфит присоединен в положение 4 никотинамидного кольца.
Аддукт сульфит-НАД связывается с аполактатдегидрогеназой сердца свиньи в 1000 раз прочнее, чем НАД+. Такой комплекс устойчив к протеолитиче-скому воздействию субтилизина [25]. Электрофильные свойства положения 4 никотинамидного кольца можно оценить, сравнив способность ряда аналогов НАД присоединять CN'-ион. Так, 5-аминопиридинаденинди-нуклеотид реагирует слабо с CN" - ионом вследствие электроположителыюгого индуктивного эффекта аминогруппы [26]. Точно так же 3-метилпиридинадениндинуклеотид, 3-пиридилкарбиноладенинди-нуклеотид, 3-амино-пиридинаденидинуклеотид не реагируют с CN" - ионом и не обладают коферментной активностью. Как правило, аналоги НАД+, обладающие меньшим сродством к CN"- иону, имеют и более отрицательный окислительно-восстановительный потенциал [27]. Знание констант равновесия реакций присоединения CN" иона позволило вычислить величины окислительно-восстановительных потенциалов ряда аналогов [28]. Оказалось, что точное соответствие между способностью присоединять CN"- ион и величиной окислительно-восстановительного потенциала, с одной стороны, и биологической активностью, с другой стороны, отсутствует. Окислительно-восстановительный потенциал 5-метилникотинамидадениндинуклеотида на 12 мВ более электроотрицателен, чем потенциал НАД+, что позволяет предположить у него большую способность восстанавливаться. Восстановленная форма этого аналога должна окисляться, наоборот, легче чем НАДН.
17 Опыты с дегидрогеназами, однако, показали, что 5-дегидроникотинамидадениндинуклеотид не окисляется в условиях окисления НАДН [27]. По-видимому, влияние метильной группы на распределение электронной плотности в кольце является причиной отсутствия коферментной активности. То же самое относится к никотинилгидразидадениндинуклеотиду и пиридил-3-альдоксимадениндинуклеотиду — аналогам, которые имеют более отрицательный окислительно-восстановительный потенциал по сравнению с НАД+ (больше, чем на 20 мВ), но их восстановленные формы реагируют в процессах, катализируемых алкогольдегидрогеназой печени лошади, почти в 2 раза медленнее, чем НАДН. Важным в ходе катализа является, вероятно, вполне определенное соответствие (комплементарность) молекулы кофермента участку связывания па поверхности фермента. Следует иметь в виду необходимость жестких требований к конформации НАД+ на стадии связывания.
Аддукты по положению «4» никотинамидного кольца в ряде случаев (например, с пируватом и диоксиацетоном) моделируют промежуточный комплекс кофермент-субстрат, вследствие чего исследование условий их образования, стабильности и возможных превращений представляется весьма перспективным.
Продукт присоединения пировиноградной кислоты к НАД+, обнаруживается в сильно щелочной среде по изменению спектров инфракрасного, ультрафиолетового и ядерно-магнитного резонанса (ЯМР) и претерпевает ряд последовательных превращений [29].Таким образом, благодаря способности ни-котинамидных коферментов к окислению и восстановлению в биологических системах они являются переносчиками Н" Н+.
1.2. Распространение пикотипамидных коферментов в животных тканях. Как следует из вышеизложенного, наиболее важная биологическая функция никотинамидных коферментов - их участие в переносе электронов и водорода от окисляющихся субстратов к кислороду в процессе клеточного дыхания. НАД+ необходим для анаэробного пути образования богатых энергией фосфорных соединений. НАДФ+ связан как с энергетическим, так и с
18 пластическим обменом веществ в клетке. Такой универсальной биологической ролью никотинамидных коферментов определяется, вероятно, и их весьма широкое распространение: они встречаются буквально во всех типах живых клеток. В последнее время образованию НАДФ-Н2 придают большое значение в регуляции клеточного метаболизма [30]. Глок и Мак-Лин [31] исследовали содержание никотинамидных нуклеотидов в различных животных тканях, используя высокоспецифичные ферментативные методы, дающие представление об истинных количествах, не расщепленных на отдельные фрагменты молекул кофермента. Результаты их исследования приведены в табл. 1.2.1.
Как видно, из приведенной таблицы, содержание никотинамидных коферментов в разных тканях весьма различно. Из всех тканей животного организма наиболее высокое содержание коферментов обнаружено в печени. Данные, полученные Глок и Мак-Лин для окисленных и восстановленных форм никотинамидных коферментов, относительно хорошо согласуются с результатами, полученными флуорометрическим методом [32], но значительно выше тех, которые приводятся в более ранних работах [33,34].
Расхождение данных разных авторов в отношении содержания никотинамидных коферментов в отдельных органах и тканях может быть объяснено тем, что и восстановленные, и окисленные формы этих соединений очень чувствительны к ферментативному и неферментативному воздействию, а потому их извлечение из тканей должно проводиться в строго контролируемых условиях. В кислой среде, как уже указывалось, восстановленные формы обоих ферментов крайне неустойчивы, в связи с чем для получения достоверных величин их содержания в тканях необходимо проводить экстракцию тканей в щелочной среде.
19 Таблица 1.2.1.
Содержание никотшшмидных коферментов в различных тканях крысы (в %) от общего количества
Представление об устойчивости окисленных форм ферментов в кислой среде в последнее время несколько изменилось в связи с появившейся публикацией Бэч и Лоури. По данным этих авторов, в печени, мозгу, сердце и почках содержится лабильный к действию кислот НАДФ+, причем в печени количество последнего достигает 75% по отношению ко всему количеству НАДФ+ [35]. НАД+, лабильного в отношении кислот, в вышеуказанных органах не найдено.
20 Каррузерс и Сунцев [36] разработали полярографический метод определения общего содержания никотинамидных нуклеотидов в различных тканях. Полученные ими значения для нормальных тканей колебались от 110 мкг/г свежей ткани для эпидермиса и 540 мкг/г для печени мыши.
В большинстве клеток НАД+ присутствует в значительно больших количествах, чем НАДФ+ [37,38]. Одним из интересных фактов регуляции дыхания является степень восстановления ферментов. В нормально функционирующих клетках наибольшая часть НАД+, как правило, находится в окисленном состоянии; НАДФ+, наоборот, при тех же самых условиях присутствует большей частью в восстановленной форме [34,37,39].
Это означает, что по сравнению с действием дегидрогеназ, использующих в качестве кофермента НАД+, преобладает механизм, окисляющий НАД-Н2 [40], и этот механизм переноса электронов составляет главный источник энергии для роста и функций клеток; в случае НАДФ+, наоборот, превалируют восстановительные механизмы. Следовательно, окисление НАДФ-Н2 через цито-хромную систему имеет второстепенное значение. Это связано с тем фактом, что весьма важные биосинтетические процессы (синтез жирных кислот, синтез стеринов и стероидов) совершаются с использованием НАДФ-Н2. Различие в соотношениях окисленной и восстановленной форм никотинамидных кофер-ментов указывает и на то, что эти коферменты не реагируют друг с другом с заметной скоростью, возможно, благодаря пространственному разобщению их внутри клетки: НАДФ-Н2 должен находиться в тех зонах клетки, где имеется сильно восстановительный потенциал, НАД+ - наоборот.
Общее содержание никотинамидных коферментов и относительные соотношения их окисленной и восстановленных форм весьма существенны для регуляции обмена веществ [41-44]. Этим, вероятно, и объясняется тот интерес, который возник к исследованию соотношений окисленных и восстановленных никотинамидных коферментов в различных тканях в норме и патологии [38,45-46]. В большинстве нормальных тканей содержание НАД+ в 2-3 раза превышает содержание НАД-Н2. Значительно большее соотношение НАД+ к НАД-Н2 об-
21 наружили Хольцер и Шульц [46] в дрожжевых клетоках. Эти авторы установили, что содержание НАД+ в клетках, выращенных при анаэробных условиях, в 400 раз выше, чем НАД-Н2. Известно, что система НАД+ - НАД-Н2 является общим звеном для ряда ферментов биологического окисления и гликолиза. Поэтому изменение характера и интенсивности процессов окисления и гликолиза должно сопровождаться изменением соотношения НАД+ и НАД-Н2 и соответственно величины окислительно-восстановительного потенциала этой системы. Возможно, что изменение соотношения НАД+ к НАД-Н2 обусловлено различным содержанием ферментов, расщепляющих преимущественно определенную окисленную или восстановленную форму кофермента [47].
В связи с вопросом о механизме регуляции содержания окисленной и восстановленной форм НАД+ в животных клетках представляет интерес работа Колотиловой, в которой на изолированных системах дегидрогеназных реакций было убедительно показано, что соотношение скоростей сс-гли-церофосфатдегидрогеназной, триозофосфатдегидрогеназной и лактико-дегидрогеназной реакций в процессах анаэробного распада углеводов определяет уровень содержания НАД+ и НАД-Н2 с преобладанием окисленной формы НАД+ [48]. 1.3. Области применения никотинамидных коферментом.
В связи с важной ролью, которую играют никотинамидные коферменты в живой клетке, препараты на их основе находят все более широкое применение. В биохимии витаминсодержащих коферментов, в силу широкого распространения в биологических системах и исключительной роли функциональности ряда основополагательных процессов жизнедеятельности, особое место принадлежит никотинамидным коферментам. Благодаря своей полифункциональности никотинамидные коферменты вовлечены в такие области физико- химической биологии, как биохимия витаминов и коферментов, энзимология (оксидоредук-ция и аллостерическая регуляция), молекулярная биология (регуляция генетической активности) и нейрохимия (нейромодуляторная роль НАД+) [49].
Пиридиновые нуклеотиды: НАД+ и НАДФ+ - наиболее распространенные коферменты в эукариотических клетках. Они долго изучались как окислительные кофакторы [50,51].
Пиридиновые нуклеотиды служат кофакторами всех известных дегидро-геназ, редуктаз и гидроксилаз, делая их главными носителями ионов Н+ и электронов, в ряде главных метаболических систем, включающих гликолиз, цикл трикарбоновых кислот, синтез стирола и синтез жирных кислот.
Также они выполняют ряд неокислительно-восстановительных функций. НАД служит субстратом для моно-АДФ-рибозила и поли-АДФ-рибозилахроматина [52,53]. И НАД+, и НАДФ+ включаются в фагосомальное получение радикалов кислорода в нейтрофилах. Недавно было установлено, что эти коферменты участвуют в комплексном процессе регулирующим движение ионов кальция. Важность пиридиновых нуклеотидов наилучшим образом иллюстрируется большим числом аналогов, которые были синтезированы для изучение различных функций. В настоящее время синтезировано примерно 200 аналогов НАД+ и НАДФ [54,55].
Ряд метаболических эффектов никотинамидных коферментов реализуется в клетках через некоферментные функции. НАДН и НАД(Р)Н, как низкомолекулярные эффекторные соединения способны выступать в роли аллостериче-ских регуляторов ферментативных процессов [49] НАД+ является субстратом в реакции ADP-рибозилирования, ведущей к образованию ADP-рибозы и её ге-мополимера - поли- ADP-рибозы. Последний, присоединяясь к акцепторным ядерным белкам, в частности, гистонам, в значительной степени определяет ин-тактность структуры ДНК и хроматина.
Показано участие НАД+ в процессах репарации ДНК.
Большинство коферментов находятся в тесной связи с витаминами. Известна профилактическая роль витаминов в охране здоровья. Отмечен и лечебный эффект при применении больших доз витаминов при некоторых заболеваниях.
Нет сомнений в том, что, по крайней мере, для значительной группы витаминов биологический эффект определяется их превращениями в кофермепты и ферменты в клетках организма. Отсюда естественными явились попытки использования коферментов с лечебными целями.
Острое локальное снижение концентрации коферментов к клеткахявляет-ся нередким патологическим признаком заболевания, и в этом случае применение готовых коферментов может быть одним из эффективных путей терапии. Это направление использования коферментов вызывает необходимость разработки практически удобных методов их синтеза, исследование их фармакологии, в том числе проблем проникновения коферментов в ткани организма, а также многих других вопросов [2].
Никотинамидные коферменты привлекают большое внимание физиологов, биохимиков и клиницистов. Установлено, что эти нуклеотиды играют первостепенную роль в жизненно важных биохимических процессах, являясь составными частями многих коферментных систем.
Никотинамидадениндинуклеотид используется в медицине как иммуно-модулятор. Он обеспечивает нейротрансмиттерную функцию - передачу нервных импульсов между мозгом и остальными органами тела. НАДН это необходимый компонент, особенно если в организме понижен уровень гормона - интерферона. НАДН является движущей силой при получении энергии клетки и антиоксидантом он защищает организм от свободных радикалов и изменений в процессе старения. Он также увеличивает способности иммунной системы и защищает клетки от токсинов и загрязнений окружающей среды. Кроме того, НАДН защищает печень от алкоголя, предотвращая образование алькогольиндуцированного ингибитора - тестостерона.
НАД+ также нормализует уровень холестерина и кровяного давления, способствует защите организма от канцерогенов. НАДН прямо включается в клеточную и иммунную систему. Мясные продукты: рыба, мясо птицы и крупного рогатого скота содержит наибольшее количество НАДН. Растительная пища содержит коферментов намного меньше. Приготовление пищи разрушает
24 большинство коферментов. А последующий процесс пищеварения разрушает их еще больше. Следовательно, применение препаратов очень полезно при многих болезнях, особенно при гепатите С. НАД+ входит в состав лекарственных препаратов, используемых для лечения болезней, связанных с нарушением деятелыюсти центральной нервной системы, таких как болезни Паркинсона и Альцгеймера. Также препараты, содержащие НАД+ используют в медицине при лечении заболеваний сердца, желудка и печени. Например, препарат «Энерго-стим», содержащий НАД+, цитохром С и инозин, применяли в терапии животных, страдающих токсико-аллергическим миокардом [56-61]. 1.4. Способы получения иикопшпамидных коферментов.
До недавнего времени никотинамидадениндинуклеотид, как правило, выделяли из животных тканей, путем действия на них мягким слабощелочным раствором карбонатом натрия [62]. Однако в настоящее время все большее распространение приобретают и другие способы получения НАД+. Существует и микробиологический способ получения никотинамидадениндинуклеотида. Микробиологический синтез никотинамидадениндинуклеотида происходит при культивировании бактерий Brevibacterium ammoniagenes с предшественником. Выращивание продуцента рекомендуется проводить на средах, содержащих глюкозу, мочевину, дрожжевой экстракт, фосфаты, соли магния, кальция и био-тин. Предшественниками никотинамидадениндинуклеотида в среде могут быть никотиновая кислота и никотин амид. Предшественники обычно вводят на вторые сутки роста культуры. К пятым суткам в среде накапливается никотинамидадениндинуклеотид, и культура вступает в фазу стационарного роста [63].
В 70-х годах в нашей стране был разработан синтез никотинамидадениндинуклеотида в культуре хлебопекарских дрожжей. Дрожжевые клетки используют для синтеза никотинамидадениндинуклеотида из предшественников в присутствии источника энергии. Реакционная смесь состоит из дрожжевых клеток (50 % по СВ) в растворе, содержит фосфаты, соли магния, аденин и нико-тинамид в качестве предшественников, а также глюкозу и экстракты хлебопекарских или кормовых дрожжей. При этом по сравнению с исходным количест-
25 во никотинамидадениндинуклеотида в клетках в ходе биосинтеза увеличивается в 10 раз. Далее происходит экстракция никотинамидадениндинуклеотида из клеток и выделение его путем ионообменной хроматографии [64].
НАД выделяют из дрожжевого экстракта, полученного при экстракции пекарских дрожжей при температуре 80-85 С в присутствии препарата - аэро-сил А-300. Дрожжевой экстракт, рН которого 6,0-6,1, пропускают через ионообменную смолу КУ-23 (Н+), НАД элюируют 0,005 н соляной кислотой. Полученный элюат еще раз пропускают через колонку с АН-132 (СГ) и затем элюируют дистиллированной водой. Для дальнейшей очистки полученный раствор НАД+ пропускают через колонку с КУ-23 (Н+) и только после элюирования 0,1 н раствором аммоний-ацетатного буфера (рН 5,8-5,9) получают раствор, содержащий 95-99% пиридиновых коферментов, из которых 62-65% составляет активный кофермент НАД+. Выход НАД+ при такой обработке составляет 50-60% [65].
С целью повышения выхода НАД+ и сокращения продолжительности процесса в патенте [66] предлагается способ получения НАД4" методом глубинного культивирования бактерий. Этот процесс можно рассматривать как двухстадийный. На первой стадии происходит накопление биомассы, а на второй, которая начинается после внесения в среду ПАВ и предшественников, рост культуры прекращается и происходит синтез НАД+. В качестве продуцента используют культуру Brevibacterium ammoniagenes АТСС 6872, которую выращивают на питательной среде, содержащей источники углерода, азота, магния, кальция, стимуляторы роста. При этом источники углерода и азота вносят дробно по мере их исчерпания в питательной среде. Культивирование ведут до накопления биомассы не менее 12 мг/мл (по сухому весу), после чего вносят ПАВ и предшественники биосинтеза НАД+. ПАВ вносят в количестве, составляющем 5-7 % от количества биомассы. Было установлено, что выход НАД+ в значительной степени зависит от соотношения ПАВ и биомассы. Отклонение от указанного интервала приводит к резкому снижению выхода НАД+. Дальнейшее культивирование ведут с целью биосинтеза НАД+, поддерживая рН в
26 среде в пределах 6,5-7,0, в течении 36-42 ч до достижения максимального количества НАД+ в среде. Вне указанного интервала рН выход НАД+ существенно ниже. Культивирование в предлагаемых условиях позволяет стабильно получать высокий выход НАД+ (5,7-6,5мг/мл) [66].
Существует и другой способ получения никотинамидадениидннуклеотида, заключающийся во вторичном культивировании дрожжей в фосфатном буфере с добавлением аденина и амида никотиновой кислоты и последующим выделением конечного продукта известными способами. С целью повышения выхода никотинамидадениидннуклеотида после выдерживания биомассы дрожжей в фосфатном буфере вводят глутаминовую кислоту и витамины группы В с одновременным добавлением источников энергии, например, сахарозы, глюкозы, уксусной кислоты. Способ осуществляют следующим образом: биомассу дрожжей суспендируют в фосфатном буфере (2,7 % RH2PO4) с добавлением аденина, амида никотиновой кислоты, и при непрерывном перемешивании и аэрации культивируют от 18 до 24 ч. Температура культивирования 25-35С, рН среды 4,5-7,0. Затем к питательной среде добавляют глюкозу, сахарозу или уксусную кислоту, смесь витаминов (Вь Вг, Вб) и є-глутаминовую кислоту. Витамины и глутаминовую кислоту можно заменить экстрактом дрожжей или кукурузным экстрактом. Процесс биосинтеза НАД+ ведут в течение 40-50 ч. НАД+ из биомассы дрожжей выделяют одним из известных способов [67].
Процесс получения НАД+, описанный в патенте [68], предполагает культивирование микроорганизмов (Saccharomyces, Candida, Torula, Schizosac-charomyces, Zygosaccharomyces и др.; Brevibacterium, Corynebacterium, Arthro-bacter, Lactobacillus, Streptococcus и др.), способных продуцировать НАД+ в водно-питатательной среде в аэробных условиях, в присутствии ПАВ. В результате добавления этого ПАВ НАД+ накапливается в культуральной жидкости. Один из используемых ПАВ (цетилтриметиламмонийбромид или цетилпи-ридинхлорид) можно добавлять в среду как в начале, так и во время культивирования. Добавляют ПАВ в количестве от 0,01-0,1 % от сухого веса биомассы.
27 Ферментацию проводят при 20-40 С, рН 5,0-9,0. После ферментации НАД^ можно выделить из культуралыюй жидкости подходящими методами, такими как ионный обмен, осаждение солями металлов, методами экстракции, хроматографией и т.п.
Известен способ получения восстановленной формы никотинамид-адениндинуклеотида. На НАД+ действуют при рН 5-8 в присутствии метафос-фата, в некоторых случаях также и глюкозы, частично лизированными клетками бактерий рода Brevibacterium или Arthrobacter и после этого также частично лизнроваными клетками дрожжей при рН 7,2-11,0. Предпочтительным является использование клеток Brevibacterium staticnis DRM 1073, Arthrobacter DRM 1075, Bnatotenula glutinus DRM 18, а также применение нативных прессованных хлебопекарских дрожжей, высушенных активированных дрожжей, прессованных нативных кормовых дрожжей или отходов в виде биомассы пивных или винных дрожжей, причем клетки могут быть иммобилизованы. Реакцию можно проводить при наличии Mg и в присутствии ингибиторов развития посторонней микрофлоры, например азида натрия или фторида натрия [69].
Известен способ микробиологического синтеза никотинамидаден-индинуклеотида, состоящий в конденсации с помощью пермеабилизованных ксилолом клеток Corynebacterium ammoniagenes ЛИА 0950, экзогенного адени-на и никотинамида на каркасе эндогенно образующегося из глюкозы рибоза-5'-фосфата, предполагающий проведение операций по выращиванию биомассы клеток и проведение катализируемых ею реакций раздельно. Пермеабилизо-ванную ксилолом клеточную биомассу в количестве 1,0 г (по СВ) суспендируют в 10 мл реакционной смеси в колбе на 100 мл, содержащей в дистиллированной воде, в %: рибозо-5'-фосфат (87,0 %-ной в виде динатриевой соли) - 1,9; глюкозу - 3,0; аденин - 0,8; однозамещенный фосфат калия - 0,1; двузамещен-ный фосфат калия - 1,4; карбонат магния 0,6 (рН 7,8).
Полученную суспензию инкубируют на качалке при температуре 34С в течение 24-30 ч до полного потребления клетками глюкозы. Содержание накопившегося в среде кофермента НАД+ составляет 19,6 мг/мл. [70].
28 Существуют также химические и ферментативные способы получения НАД+.
Высокоочищенный НАД+ получали из пекарских дрожжей с последующим хроматографическим отделением и осаждением тяжелыми металлами [71,72,73]. Позже процесс осаждения исключили из-за большой трудоемкости и коллоидной природы оставшихся солей.
Далее был изучен процесс очистки НАД+ ионно-обменной хроматографией и угольной адсорбцией [74,75,76,77]. Среди них, процесс, предложенный в [75,76] оказался наиболее подходящим, поскольку дает наибольший выход продукта [76]. Метод, описанный в [75] очень простой, но выход продукта здесь очень незначительный. В [77] и [74] были получены одинаковые результаты по сходным методам. В данной статье приводится простой и воспроизводимый метод получения НАД+. Выделение кофермента состоит из следующих стадий:
5 кг (сухих) дрожжей суспендировали в 8,5 л воды и экстрагировали при 100 С 4 минуты. Смесь охлаждали до 50 С добавлением расколотого льда, затем до комнатной температуры под потоком воды и затем отфильтровывали.
Очистка на анионите. Экстракт с рН 6,5 был пропущен со скоростью 75 мл /мин на колонке высотой 22 см, диаметром 5 см через анионит Relite 3 AS (СІ). Далее смола была промыта 1 л дистиллированной воды и 1 л 0,1 н хлорида натрия с рН 2,5. Первые 3,5 л элюата были отброшены, а остальные объединены.
Адсорбция на угле и осаждение. Полученный раствор, доведенный до рН 3, перемешивали с 70 г угля и затем выдержали 12 ч при +5 С. Полученную смесь декантировали , уголь отфильтровали, промыли 1л воды , затем дважды по 500 мл смесью воды с ацетоном (7:3) и наконец проэкстрагиро-вали 3 раза смесью этилацетат:ацетон:вода:аммиак в соотношении (100:500:400:2). Полученные экстракты были обработаны 1800 мл ацетона
29 при -20 С. Полученный осадок отфильтровали, промыли холодным ацетоном и высушили под вакуумом. 4) Сорбция на анионите. Осадок растворли в 40 мл воды, рН довели до 8 и пропустили данный раствор через колонну высотой 8 см и диаметром 1,2 см со скоростью 1 мл/мин, заполненную ионитом Dowex 1x2 (в формиат-ной форме). Колонна была промыта 20 мл дистиллированной воды. Десорбцию провели 0,05 н муравьиной кислотой. Первые 140 мл элюата отбросили, а следующие 90 мл собрали и довели рН до 2 и обработали 6 объемами ацетона при -20 С. Отфильтровали и также высушили. Общий выход на стадии сорбции и осаждения составил 70%, а чистота продукта 75%. Окончательная ионная очистка дала 90% НАД+ с выходом 85%, а общий выход от первой стадии составил 55%. НАД+ получают исключительно из биомассы дрожжей, при этом расходная норма дрожжей составляет примерно 453 г по СВ на 1 г НАД+. Себестоимость производства примерно 160 $ за грамм НАД+.
Типичный процесс получения НАД+ из дрожжей описан в [78]. Процесс плазмолиза пекарских дрожжей проводится в кипящей воде. После удаления клеток из экстракта с помощью ацетата свинца добавляют нитрат серебра и экстракт оставляют на 12 ч, после чего обрабатывают сероводородом. НАД+ получается в виде свободной кислоты путем осаждения ацетоном. Дальнейшая очистка проводится путем ионно-обменной хроматографии.
НАД+ может быть также синтезирован из никотинамидмононуклеотида (НМН) и АМФ. Однако НМН может быть получен только многостадийным синтезом [79]. Основная проблема синтеза НМН состоит в том, что он должен быть получен из р-рибофуранозных остатков, которые являются термолабильными соединениями. Для удобства в известных методах синтеза, как сообщается в [79], требуется присутствие защитных групп для того, чтобы сохранить остатки рибозы в фуранозной форме. Более того, в методе [79] необходимо фос-форилировать р-никотинамидрибозу на конечной стадии получения НМН. Добавление фосфатной группы - это трудоемкий процесс, и выходы НМН невы-
сокие. Кроме того, этот метод не дает возможности получать рибозиламин-5-фосфат как химически чистый интермедиат. Такой интермедиат сам по себе тоже может использоваться для получения антибиотиков и антивирусных агентов, например, рибовирина.
Следует обратить внимание на статью [80]. Было установлено, что НАД+ может быть получен из простых исходных веществ, таких как АМФ или рибо-зо-5-фосфат. Он может быть получен путем последовательных реакций, использующих химические или ферментативные катализаторы. Эта последовательность реакций может быть проведена в одном реакторе. Конечный препарат НАД+ может использоваться в органических реакциях без дополнительной очистки.
НМН получают из рибозиламин-5-фосфата путем конденсации с подходящей солью, например, с такой как >П-(2,4-динитрофенил)-3-карбомилпиридинхлорид (НДС). При конденсации НМН из уже фосфорилиро-ванного рибозиламина сложность состоит в селективном фосфорилировании гидроксилыюй группы. Также рибозиламин-5-фосфат синтезируют из АМФ или из рибозо-5-фосфата. При синтезе из АМФ стехиометрические количества АМФ превращаются в рибозу-5-фосфат путем кислотного гидролиза. При синтезе рибозо-5-фосфата требуется обработка безводным аммиаком, с осушающим растворителем, таким как полигидриловый спирт.
Получение НАД+ из НМН осуществляется путем связывания НМН с АТФ на стадии, катализируемой НАД-пирофосфорилазой иммобилизированной в полиакриламидный гель [81]. Ферментативное связывание НМН приводит к гидролизу с образованием пирофосфата. Выход составляет 90 - 97 %.
Полученный НАД+ может быть превращен в НАДФ обработкой продукта НАД-киназой. Как НАД+, так и НАДФ могут быть превращены в НАДН и НАДФН соответственно, используя стандартные методы и агенты.
Другое преимущество данного изобретения [82] - это рецикл кофактора АТФ. Для этого динатриевую соль рибозо-5-фосфата 88 % чистоты растворяют в этиленгликоле, раствор охлаждают до 0С и обезвоживают. Через раствор
31 барботируют аммиак в течении часа. Желтую реакционную смесь выдерживают в холодильнике при 4 С в течении недели. Избыток аммиака удаляют: сначала используют роторный испаритель, а затем вакуумный. НДС растворяют в метаноле и перемешивают в темноте в течение 18 часов при 25 С. Затем добавляют воду и фильтрацией удаляют 2,4-динитроанилин. Избыток НДС удаляют адсорбцией на активированном угле и фильтруют. Конечный раствор содержит 125 ммоль р-НМН. С другой стороны, (3-НМН может быть получен следующим образом. К этиленгликолю добавляют аммиак в течение часа. Затем быстро добавляют динатривую соль рибозы-5-фосфата. Аммиак барботируют ещё 15 минут. За это время рибоза-5-фосфат растворяется. Раствор перемешивают в течении 15 часов при 5 С. Удаляют аммиак также как и в предыдущем случае и добавляют холодный раствор НДС. Реакционная смесь становится насыщенно красной. Перемешивают 14 часов, при 5 С. Реакционную смесь разбавляют двумя объёмами 0,6 М буфера HEPES (рН 7,4) и центрифугируют. Динитроа-нилин и избыток НДС осаждают и прозрачный раствор используют на ферментативной реакции. Для нее берут 20 ммоль НМН, 25 ммоль АМФ, 2 ммоль АТФ и 100 мл полиакриламидного геля. Реакционную смесь разводят водой и устанавливают рН на уровне 7,2. Добавляют хлорид магния и 1,3-димеркаптан-2-пропанол в качестве антиоксиданта. Реакцию проводят в токе аргона. Затем добавляют диаммонийацетилфосфат и перемешивают перистальтическим насосом 10 суток. В результате получают 39 ммоль НАД+. Реакционную смесь декантируют. Раствор, содержащий НАД+, можно использовать без дальнейшей очистки в качестве источника НАД+ и НАДН. Если НАД+ - содержащий раствор обработать НАД-киназой и АМФ, то получается НАДФ или НАДФН. Если НАД+ необходим в сухом виде, он может быть получен с чистотой больше 50 %, при пропускании кислого раствора через ионит Dowex 50 (Н+ форма), с последующим осаждением примесей гидроксидом бария и осаждением НАД+ этиловым спиртом.
Для восстановления НАД+ и НАДФ используются также химический метод котором восстанавливающим агентом является дитионит натрия (NaiSiO,*),
32 однако в этом случае образуются ингибиторы, поэтому получаемый НАДН нельзя использовать, как биохимический реагент. Поскольку при ферментативном восстановлении дегидрогеназами, в которых используются НАД+ и НАДФ, не образуются такие ингибиторы, то этот метод предпочтительнее для получения НАДН и НАДФН [83].
Для ферментативного восстановления НАД+ существует метод, использующий формиатдегидрогеназу [84]. Но проблема состоит в использовании муравьиной кислоты в промышленном производстве, поскольку это жидкость с неприятным запахом вызывает коррозию аппаратуры и язвы при попадании на кожу. Для ферментативного восстановления НАД+ используют следующие методы: с использованием глюкозо-6-фосфатдегидрогеназы [85], с использованием глюкозадегидро-геназы [86] и метаногенных бактерий [87]. В этих методах щелочная среда (рН 9) способствует повышению эффективности процесса извлечения восстановленных форм НАДН и НАДФН, но с другой стороны, в таких условия снижается выход НАД+ и НАДФ из-за их нестабильности в щелочной среде. В связи с этим, авторы [34] ставили целью найти метод, подходящий для промышленного получения НАДН и НАДФН.
Восстановление должно проводиться в нейтральной среде. Это связано с тем, что НАД1" и НАДФ легко разрушаются в щелочной среде, а НАДН и НАДФН в кислой. Следовательно, чтобы получить НАДН или НАДФН необходимо работать в диапазоне рН от 6 до 8.
Эти авторы предлагают метод получения НАДН и НАДФН, в котором они получаются по реакции НАД+ и НАДФ с малоновой кислотой в присутствии малатдегидрогеназы по уравнению:
малатдегидрогеназа
L-малоновая кислота + НАДФ пируват + С02 + НАДФН + РҐ
Данная реакция происходит почти при нейтральном значении рН 7,5, так что лишь небольшие количества субстрата и фермента разрушаются, и также практически не происходит разрушения НАД+ (НАДФ) и НАДН (НАДФН). Кроме того, когда реакция происходит при пониженном давлении, из реакци-
33 онной среды удаляется С02, что приводит к смещению равновесия в сторону НАД+ и НАДФН. В данном изобретении [34] может быть использован фермент из любого источника, если он имеет малатдегидрогеназную активность, например, из Escherichia coli или Lactobacillus arabinosus. В качестве источника фермента служат сами клетки, либо их обрабатывают органическим растворителем для выделения фермента или проводят иммобилизацию фермента.
Во многих процессах ферментативного синтеза используются пиридиновые коферменты, такие как НАДН, которые включаются в окислительно-восстановительный механизм. Они используются в процессах для ферментативного синтеза органических продуктов. Однако реализация результатов, полученных в лаборатории, в промышленных масштабах требует регенерации пиридиновых коферментов, которые слишком дороги, для того чтобы использоваться в стехиометрических количествах однократно. Более того, отсутствие эффективных методов регенерации коферментов, сдерживает развитие их промышленного получения.
По этой причине многие исследования направлены на поиск оптимальных условий их регенерации, которая может быть выполнена химически, электрохимически или ферментативно в соответствии со схемой 1.4.1.
Анализ преимуществ и недостатков различных методов, показывает, что не существует удобного метода регенерации [88] коферментов. Методы регенерации НАДН представлены на рис. 1.4.1. Механизм А иллюстрирует химическую регенерацию. Молекула регенерируется путем восстановления НАД+ в НАДН. Для восстановления можно использовать водород [89], но он взрывоопасен. Механизм В иллюстрирует ферментативную регенерацию ферментом, который взаимодействует с несколькими субстратами. Один и тот же фермент катализирует и реакцию синтеза, и реакцию регенерации. Механизм С иллюстрирует процесс синтеза и регенерации, каждый из которых использует свой фермент и свой субстрат.
Механизм D иллюстрирует электрохимическую регенерацию. В случае восстановления НАД+ ферментативные методы дают лучшие результаты. Сре-
34 ди используемых субстрат ферментных систем следует отметить: форми-ат/формиатдегидрогеназа, глюказа-6-фосфат/глюкоза-6-фосфатде-гидрогеназа, этанол/алькогольдегидрогеназа.
NAD +
NADH NAD*
NADH NAD+
NADH NAD +
NADH
A
>
'В A
>
>
^
>
Рис. 1.4.1. Методы регенерации НАДН по данным [88]. Этот метод предполагает использование дегидрогеназы из Alcaligenes eiitrophus, для восстановления НАДН водородом [90]. Однако стабильность связанного фермента очень низкая, особенно сильно он подвержен окислению различными агентами. Электрохимические процессы привлекательны тем, что они позволяют достичь высокой скорости регенерации, путем выбора электродного потенциала. Более того, есть возможность наблюдения за ходом реакции во время процесса. Однако применение этой реакции ограничивается использованием некоторых реагентов, которые могут реагировать непосредственно с электродом. Электрохимическое восстановление НАД+ эффективно происходит на ртутном электроде. На этом электроде НАДН образуется в чистом виде. На платиновом электроде восстановление НАД+ дает смесь НАДН и (НАД)2. В данном патенте [91] предполагается использовать сочетание ферментативного и электрохимического методов, что приводит практически к 100% восстановлению кофермента.
35 Был разработан метод экстракции пиридиновых нуклеотидов из образцов тканей при комнатной температуре, который позволяет проводить совместную экстракцию для обоих (окисленного и восстановленного) нуклеотидов при использовании 70% этанола в буфере в качестве экстрагента. Выходы НАД+ и НАДН были 91 и 100% соответственно [92].
Химический способ получения НАДН и НАД+ из авокадо был описан в статье [93]. Навески массой 6 г фруктовой ткани были заморожены в жидком азоте и затем измельчены в порошок. Одну часть порошка перенесли в центрифужный стакан, который содержал 12 мл ОДн НС1 для экстракции НАД+, а другую в центрифужный стакан, который содержал 12 мл ОД н NaOH для экстракции НАДН. После 20 минут выдерживания на холоду при постоянном перемешивании, стаканы помещали в кипящую воду на 2 мин и сразу переносили в ледяную баню на 15 минут. Пробы были отфильтрованы через 4 слоя марли, после этого в каждый стаканчик добавляли 1 мл 500 мМ К3РО4 буфер (рН 7,5). Затем пробы были нейтрализованы до рН 7,3-7,5, при перемешивании на холоду путем добавления 1 н NaOH к кислому экстракту и 1 н НС1 к щелочному экстракту, соответственно. Экстракты отцентрифугировали при 27000 g в течение 10 мин при 4 С. Супернатанты декантировали, отфильтровали через 4 слоя марли и поставили в ледяную баню. Концентрации НАД+ и НАДН были измерены с помощью чувствительной циклической ферментативной реакционной системы, где НАД+ или НАДН использовались как лимитирующие скорость компоненты, с использованием феназинметасульфата и алькогольдегидрогена-зы. Степень экстракции НАД+ и НАДН из фруктовой ткани была 83 % и 78 % соответственно.
В работе [94] предложен метод эффективной инактивации метаболизма и количественной экстракции метаболитов из дрожжевых клеток. Этот метод основан на использовании кипящего раствора 75% этанола в 70мМ буфере HEPES, рН 7,5. Раствор такого состава гарантирует стабильность до конца процесса большинства метаболитов, включая все гликолитические производные, нуклеотиды, пиридиновые нуклеотиды и органические кислые со-
36 единения. Используя эти экспериментальные условия НАД+ был извлечен на 90-95 %, содержание НАД+ определялось флуорометрически путем восстановления его в НАДН, в присутствии алькогольдегидрогеназы. Достоинство метода состоит в том, что экстракция проходит с большой скоростью и требует только трех минут инкубации дрожжевых клеток в этанол-буферной смеси выдерживаемой при 80С. Этот метод может быть выполнен, как путем непосредственного помещения клеток в кипящую смесь, так и после выдерживания культуры клеток в 60 % метаноле при - 40С. Экстракты сразу же концентрировали путем выпаривания под вакуумом и остаток суспензировали в малом количестве воды. Эта позволяет количественно извлекать метаболиты из клеток массой меньше 10 мг.
В работе [95] предложен метод выделение НАДН из Saccharomyces сеге-visiae путем обработки эфиром и очистка его афинной ультрафильтрацией.
Клетки дрожжей были обработаны эфиром, для выделения кофермента НАДН. Увеличение концентрации НАДН в четыре раза в эфирной фракции по сравнению с водной соответствует выходу 80 %. НАДН был отделен и очищен афинной ультрафильтрацией, с использованием дрожжевой алькогольдегидрогеназы, как афішного леганда. Были установлены характеристики химической связи фермента и кофермента, при различных рН и ионных силах растворов, используя гельфильтрацию. Количество молей НАДН сязанных с 1 моль алькогольдегидрогеназы, оказалось равным 5,7 моль при рН 8 и ионной силе равной 0,1 моль.
Бинарный комплекс НАДН и алькогольдегидрогеназы был сконцентрирован при рН 6. После ультрафильтрации провели диафильтрацию. В результате получили НАДН с соотношением А2бо /А340 равно 2,3 и выход кофермента составил 68%. Выход алькогольдегидрогеназы был 93 % и потеря активности 15 %. 1.4. Выделение и очистка никотинамидных коферментов.
Получение восстановленного НАДН, как, оказалось, приводит к наличию в продукте примесей, некоторые из которых ингибируют дегидрогеназную активность [96-98]. Некоторые из этих примесей могут быть обнаружены с по-
37 мощью тонкослойной [99] или колонной хроматографии [97]. Однако относительные количества примесей могут быть более просто определены методом колонной хроматографии, особенно с использованием ультрафиолетовых детекторов. К таким методам относятся ионообменная хроматография (обычно с использованием DEAE-целлюлозы) в щелочных условиях, однако эти методы не способны отделять другие адениновые нуклеотиды от НАДН [96,97,100-102].
Ионообменные методы хроматографии в кислых рН [103] или с использованием поливалентных анионов [104-106] не подходят, потому что НАДН не устойчив в кислой среде. Использование ионного обмена для очистки НАДН подробно описано во многих публикациях [96,100-102], но не один из этих методов не может полностью удалить известный дегидрогеназный ингибитор АДФ-рибозу. Первоначально наличие АДФ-рибозы, как примеси к НАДН, было установлено Далзиелом [97] с использованием бумажной хроматографии. Сильверстейн [101] предложил отделять АДФ-рибозу от кофермента хроматографией на DEAE-целлюлозе. Этот носитель концентрирует в первую очередь пик НАДН, который определяется по соотношению А2бо /А340 который сначала уменьшается, а затем возрастает, но чистый НАДН никогда не получается. Зи-герхон и др. [107] сообщили, что средний сегмент пика НАДН получался хроматографией на QUA-sephadex, и обеспечил постоянное соотношение Агбо /А34(ь но повторная хроматография в той же системе показала, что пик НАДН все еще содержит загрязнитель АДФ-рибозу во фракциях с первой по четвертую. Соотношение Агбо /А340 Для следующих семи фракций было 2,265 ± 0,012. Этот разброс получился из-за присутствия 1% АДФ-рибозы, или других веществ, поглощающих при 260 нм. Условия ионно-обменной хроматографии для очистки НАДН осложнились нестабильностью НАДН в кислой среде [108] и нерастворимостью этого сильнополярного соединения в различных растворителях используемых в хроматографии.
38 Высокоэффективная жидкостная хроматография (ВЭЖХ) может быть проведена при условиях обеспечивающих стабильность НАДН и метод имеет дополнительное преимущество в том, что он быстрый. При применении ВЭЖХ к коммерческому препарату НАДН было отделено 10 пиков примесей. Эти примеси присутствовали в следовых количествах в технических и полностью отсутствовали в высокоочищенных продуктах.
НАДН очищенный хроматографией на DEAE-целлюлозе, оказался более чистым, чем препарат очищенный ВЭЖХ. Он имел максимум поглощения при А259,4 и А3з9, и соотношение А2бо /Аз4о 2,261± 0,002. Такой результат был получен с помощью с помощью использования в качестве элюента бикарбоната аммония, который находился под слоем азота.
Очистка и устойчивость никотинамидных коферментов изучалась также в работах [109]. Промышленные образцы не радиоактивных коферментов содержат различные примеси, которые снижают ферментативную активность и должны быть удалены путем очистки. Очистка и выделение очень специфичны в случае получения микро количеств радиоактивных коферментов. Например, такие крупномасштабные методы, как осаждение хлоридом лития, не подходят для малых количеств восстановленных коферментов. Часто очистка синтезируемых никотинамидных производных достигается при помощи ионно-обменной хроматографии на ОЕАЕ+-целлюлозе с использованием буферных растворов. Некоторые из этих методов используют ацетатные и фосфатные буферы, то есть такие анионы, которые не вызывают разрушение восстановленных никотинамидных коферментов. Метод очистки, который представлен в данной работе, исключает использование фосфатов и ацетатов и позволяет сохранить чистоту НАДФН около 97 % более 24 месяцев.
Стабилизация НАДФН достигается при использовании нескольких условий: высокий рН 9-9,5, высокая ионная сила (элюент с концентрацией 200 ММоль/л NaCl), низкая температура = 80С.
Присутствие фосфатов, ацетатов и других дестабилизирующих ионов также исключается в соответствии с данными предыдущих статей.
39 Среди других никотинамидных коферментов НАДФН наиболее лабильный, однако этот метод очистки НАДФН больше подходит для более стабильного НАДН.
К сожалению, до настоящего времени в России не организован промышленный выпуск никотинамидных коферментов, цена 1 г НАДН и НАД+ у зарубежных фирм составляет соответственно 50-250$ и 60-300$.
Анализ литературных данных показывает, что исследованию механизмов действия никотинамидных коферментов, их биохимической роли, биосинтезу и способам очистки посвящено большое число работ отечественных и зарубежных авторов. Однако в литературе отсутствуют данные по разработке способов выделения никотинамидных коферментов из биомассы дрожжей, которые можно было бы использовать в промышленности.
Также в литературе отсутствуют данные по математическому моделированию стадий выделения и очистки никотинамидных коферментов.
В связи с этим в работе были поставлены задачи:
Разработать малоотходную технологию извлечения никотинамидных коферментов при попутном выделении НК из биомассы хлебопекарских дрожжей Saccharomyces cerevisiae.
Подобрать оптимальные условия процесса экстракции никотинамидных коферментов из биомассы хлебопекарских дрожжей.
Разработать стадии выделения и очистки никотинамидных коферментов.
На основе полученных экспериментальных данных построить кинетические схемы для управления стадиями технологического процесса.
Структура и основные физико-химические свойства никотинамидных коферментов
При разработке основ технологии получения никотинамидных кофермен-тов необходимо, прежде всего, знать химические свойства выделяемых веществ, чтобы подобрать условия проведения технологических стадий. Поэтому рассмотрим результаты последних исследований физико-химических свойств никотинамидных коферментов. Структура и основные физико-химические свойства никотинамидных коферментов.
К пиридиновым или никотинамидным коферментам относятся нуклеоти-ды, содержащие в качестве каталитически активной группировки амид никотиновой кислоты. Основными представителями этой группы ферментов являются два нуклеотида, которые обозначаются рациональными названными: никоти-намидадениндинуклеотид (НАД+) и никотинамидадениндинуклеотид фосфат (НАДФ+). Химическая структура обоих нуклеотидов представлена на рис. 1.1.1.
Никотинамидные коферменты по своему строению являются фосфатами (3-N-рибофуранозидов замещенного пиридиния; в 5 -положении они содержат пиро-фосфатную группировку. Различаются эти два кофермента лишь строением группировки, присоединенной ко второму остатку фосфорной кислоты. В молекуле НАД+ этот остаток аденозина, а в НАДФ+ - остаток аденозин-2 -фосфорной кислоты [1]. Молекула НАД+ состоит из двух гетероциклов - пиридинового и аденино-вого, соединенных цепочкой из двух остатков рибозы и остатка пирофосфорной кислоты.
Активной частью молекулы является никотинамидное кольцо, участвующее в окислительно-восстановительных реакциях и в реакциях присоединения нуклеофильных агентов. Восстановление его с помощью дитионита натрия, а также субстратами в реакциях, катализируемых ферментами, приводит к образованию НАДН - 1,4-дигидроникотинамидадениндинуклеотида [2].
В растворе НАД+ проявляет свойства слабой кислоты. Было выполнено потен циометрическое титрование НАД+ гидроксидом натрия при различной ионной силе раствора [3]. Методом экстраполяции к нулевой ионной силе была найдена термодинамическая величина рКа, значение которой составило 3,88±0,02. В молекуле НАД+ заряд пиридиниевого катиона компенсируется отрицательным зарядом одной из фосфатных групп. Природа группы, ионизация которой обнаруживается в растворе, точно не установлена. Согласно исследованиям спектров ПМР, скорее всего это может быть ароматический атом Nt адепинового кольца [4, 5]. Характерным свойством никотинамидных коферментов являются их спектры поглощения в ультрафиолетовой области спектра. НАД+ и НАДФ+ характеризуются полосой поглощения с максимумом при 260 нм. У восстановленных форм (НАД-Н2 и НАДФ-Н2) появляется новая полоса поглощения с максимумом при 340 /ш; возбуждение НАД-Н2 и НАДФ-Н2 излучением с этой длиной волны вызывает флуоресценцию с \шс при 480 нм. Спектрофотометрические и спек-трофлуорметрические методы, основанные на этих свойствах, применяются для аналитического определения никотинамидных коферментов и для измерения связанных с ними дегидрогеназ (рис. 1.1.2). [1].
Как положение максимума, так и интенсивность поглощения этой полосы может меняться в зависимости от полярности среды, что определяется относительным структурным вкладом хиноидной формы НАДН, несущей положительный и отрицательный заряды, соответственно на атоме азота пиридинового кольца и атоме кислорода карбоксамидной группы.
Определение концентрации нуклеиновых компонентов в растворах и содержания нуклеиновых компонентов в готовом продукте
Содержание нуклеиновых компонентов (НК) определяли по методу А.С. Спирина [62]. Сущность метода сводится к гидролитическому отщеплению азотистых оснований от молекулы нуклеиновой кислоты при кипячении ( 90С) в течение 15-20 минут в присутствии 0,5н хлорной кислоты и последующей спектрофотометрической регистрации отщепленных оснований.
Концентрацию нуклеиновых компонентов в растворе /НК/ выражали в мкг/мл и рассчитывали по формуле:
[НК]=(А270-А290)-Р-2-54,21, где А27о- поглощение при 270нм, измеренное на спектрофотометре в кювете с толщиной поглощающего слоя 10мм;
А29о- поглощение при 290нм, измеренное на спектрофотометре в кювете с толщиной поглощающего слоя 10мм;
Р- разведение анализируемого раствора, без учета разведения при добавлении 1н хлорной кислоты; 2 - разведение при добавлении хлорной кислоты; 54,21- пересчетные коэффициенты для расчета значений концентрации нуклеиновых кислот в г/л.
Содержание нуклеиновых компонентов (%) в готовом продукте рассчитывали по формуле:
,( - )-100-2-54,21-25 100- разведение приготовляемого раствора-образца; 25- объем приготовленного раствора, мл; Н - навеска анализируемого образца, мкг; За окончательный результат испытаний принимали среднее арифметическое трех параллельных анализов.
Общее содержание азотсодержащих веществ определяли микрометодом Кьельдаля [62]. Расчет проводили по формуле:
N = (Vk-14 0,l -100)/(10 н)) 100%, где N - содержание общего азота в исследуемом материале, %; Vk - объем серной кислоты, пошедший на титрование пробы, мл; 14 - масса 1 мг-экв азота, мг-экв/мг;
0,1 - нормальность раствора серной кислоты, используемого для титрования, мг-экв/мл;
100 - объем анализируемого раствора, мл; 10 - объем пробы, взятой для анализа, мл; н - навеска анализируемого материала, мг.
Содержание белковых веществ определяли модифицированным методов Лоури с предварительным осаждением белков и крупных пептидов 50%-ной три хлоруксусной кислотой [62], используя альбумин из человеческой сыворотки ква лификации чда для построения калибровочной кривой. Расчет содержания белко вых веществ, осаждаемых 50%-ной ТХУ проводили по формуле: P = С N/V, где: P - содержание белковых веществ, мг/л; С - концентрация белковых веществ, найденная по калибровочному графику, мг/л; N - разведение анализируемого раствора; V - объем пробы, взятой для анализа. Содержание белковых веществ, неосаждаемых 50%-ной ТХУ, определяли по формуле: РР = С 2 Р , где РР - содержание белковых веществ в анализируемом материале, мг/л; С - концентрация белковых веществ, найденная по калибровочному графику, мг/л; Р - разведение анализируемого раствора; 2 - разведение за счет добавления ТХУ.
Экстракция никотинамидных коферментов из клеток хлебопекарских дрожжей водными растворами. Количественные закономерности процесса
Анализ литературных данных показывает, что наиболее перспективным сырьем для получения никотинамидиых коферментов (НА КФ) является биомасса микроорганизмов (дрожжей и бактерий). Наиболее целесообразно использовать для этой цели хлебопекарские дрожжи Sacharomyces cerevisiae, являющиеся отходом спиртовой промышленности и образующиеся в таком производстве в значительных объемах.
Из литературы известно, что содержание НА КФ в дрожжах сильно варьирует в зависимости от вида сырья и условий культивирования. Однако в любом случае наблюдается следующая закономерность: максимальное содержание НА КФ в биомассе достигается к концу логарифмической фазы роста, причем содержание никотинамидадениндинуклеотитида окисленного (НАД+) колеблется в пределах 0,1-0,3 %, содержание никотинамидадениндинуклеоти-тид фосфата окисленного (НАДФ+) 0,01-0,025 %, а содержание восстановленных форм коферментов колеблется в пределах 0,04-0,08 % от массы СВ дрожжей. Таким образом, с экономической точки представляется целесообразным извлекать из биомассы дрожжей именно НАД, содержание которого в клетках максимально по сравнению с другими НА КФ.
В качестве объекта исследования в работе была использована нативная биомасса хлебопекарских дрожжей Saccharomyces cerevisiae, отбираемая в конце логарифмической фазы роста, содержащая 6,0 % нуклеиновых компонентов (НК), 0,18 % НАД, 0,08% НАДН+НАДФН в расчете на воздушно сухое вещество (СВ). Ввиду методических сложностей раздельно содержание НАДН и НАДФН не определи, а находили только их суммарное содержание. Поскольку НАД в основном содержится в мембранных компонентах клетки, то для его извлечения наиболее просто применить метод экстракции слабощелочными и слабокислыми водными растворами в условиях аналогичных стадии плазмолиза, широко используемой в производстве кормовых дрожжей [ПО]. В таких условиях не происходит полного разрушения клеточных мембран, а лишь их частичное разрыхление, что обеспечивает переход в раствор только низкомолекулярных компонентов клетки, к которым относятся, в частности НА КФ.
Приступая к разработке научных основ технологии выделения и очистки никотинамидных коферментов из биомассы хлебопекарских дрожжей Sacharo-myces cerevisiae, на первом этапе исследований было необходимо выяснить закономерности извлечения НА КФ из клеток дрожжей и определить оптимальные условия проведения данной стадии на основе кинетической схемы, описывающей процесс водной экстракции НА КФ.
Известно, что НАД+ более устойчив при кислых значениях рН среды, а восстановленные формы НА КФ - при щелочных. Причем в слабокислой среде происходит параллельное извлечение НАД и НАД(Ф)Н с последующим окислением НАД(Ф)Н в НАД+ НАДФ+, что позволяет увеличить выход последнего. Поэтому при создании кинетической схемы процесса экстракции НАД+ мы исследовали также процесс экстракции НАД(Ф)Н из биомассы дрожжей.
Исследуемыми параметрами процесса явились: температура, рН среды и содержание СВ микробных клеток в объеме жидкой фазы. Данные параметры варьировали соответственно в интервалах 60-90 С; 6,0 - 10,9; 2,5-10.
Содержание НАД+ и НАД(Ф)Н в экстрактах определяли, используя методики, приведенные выше в разделе «Материалы и методы».
На рис. 3.1.1 в координатах время экстрагирования (т)-степень извлечения НАД+ и ХНАД(Ф)Н (х) приведены соответствующие кинетические кривые экстракции при постоянном значении температуры и рН среды, отвечающие различной начальной концентрации СВ дрожжевой суспензии. Из рис. 3.1.1 видно, что зависимость х от СВ биомассы в пределах доверительного интервала отсутствует, что позволяет сделать вывод о наличии формально первого порядка процесса экстракции. Поэтому при выборе оптимального содержания СВ в суспензии мы руководствовались технологическими соображениями, касающимися оптимальных условий перемешивания, снижения потерь конечного продукта при отделении биомассы на стадии сепарации и минимизации объе мов перерабатываемых суспензий, а также опытом работы аналогичных производств. С учетом всего вышеизложенного в качестве оптимального было выбрано содержание СВ дрожжей 10%.