Содержание к диссертации
Введение
ГЛАВА 1 Современное состояние и перспективы развития технологии концентрирования меди из рудного сырья 9
1.1 Мировая минерально-сырьевая база меди 9
1.1.1 Геолого-промышленные типы месторождений меди 9
1.1.2 Ресурсы меди по странам 11
1.2 Отечественная минерально-сырьевая база меди и ее особенности 12
1.2.1 Классификация медноколчеданных руд России 16
1.2.2 Практика и перспективы обогащения медноколчеданных руд на обогатительных фабриках Урала 19
1.3 Применение автоклавных технологий для кондиционирования труднообогатимых колчеданных руд 22
1.3.1 Общие закономерности автоклавного окисления сульфидов 23
1.3.2 Механизм и кинетика автоклавного окисления основных минералов входящих в состав медных концентратов 26
1.3.3 Автоклавное выщелачивание в металлургии меди 35
1.4 Постановка задачи исследования 45
ГЛАВА 2 Определение кинетических характеристик процесса автоклавного выщелачивания цинка из флотационного медного концентрата 48
2.1 Исследование вещественного состава флотационного концентрата 48
2.2 Методы расчета кинетических характеристик 52
2.1.1 Классический метод 53
2.1.2 Метод по модели «сжимающегося ядра» 55
2.3 Методика экспериментов 58
2.4 Определение кажущейся энергии активации 60
2.4.1 Определение кажущейся энергии активации по классическому методу . 60
2.4.2 Определение кажущейся энергии активации по модели «сжимающегося ядра» 62
2.5 Определение кажущегося порядка реакции по кислороду 65
2.5.1 Определение кажущегося порядка по кислороду по классическому методу 66
2.5.2 Определение кажущегося порядка по кислороду по модели «сжимающегося ядра» 69
2.6 Обсуждение результатов 70
2.7 Выводы к главе 2 72
ГЛАВА 3 Автоклавное кондиционирование низкосортного сульфидного медного концентрата 73
3.1 Исследование процесса автоклавного кондиционирования 73
3.1.1 Определение аэрационных характеристик автоклавного агрегата 73
3.1.2 Методика экспериментов 75
3.2 Результаты экспериментов и их обсуждение 75
3.2.1 Влияние технологических параметров на выщелачивание цинка и меди75
3.2.2 Поведение минералов меди при выщелачивании 80
3.3 Характеристика продуктов автоклавного кондиционирования 88
3.3 Выводы к главе 3 90
Глава 4 Разработка технологии гидрометаллургического кондиционирования низкосортных медных концентратов 91
4.1 Переработка растворов автоклавного выщелачивания 91
4.1.1 Методы концентрирования цинка из растворов автоклавного выщелачивания 91
4.2.1 Результаты экспериментов по концентрированию цинка из растовров и их обсуждение 93
4.2 Разработка технологической схемы автоклавного кондиционирования низкосортных медных концентратов 96
4.2.1 Исходные данные для проектирования предприятия по
кондиционированию медных концентратов 97
4.3 Экономические показатели предприятия по кондиционированию низкосортного медного концентрата 102
4.4 Выводы к главе 4 106
Заключение 107
Список сокращений и условных обозначений 109
Список литературы
- Геолого-промышленные типы месторождений меди
- Определение кажущейся энергии активации по классическому методу
- Результаты экспериментов и их обсуждение
- Результаты экспериментов по концентрированию цинка из растовров и их обсуждение
Геолого-промышленные типы месторождений меди
Актуальным направлением совершенствования существующих технологий переработки низкокачественных медных концентратов, наряду с максимальным использованием возможностей, связанных с обогатительным циклом, является ее модернизация с применением гидрометаллургических процессов, в частности автоклавного кондиционирования [20-25]. 1.3.1 Общие закономерности автоклавного окисления сульфидов
Вопросу поведения сульфидов тяжелых цветных металлов при окислительном автоклавном выщелачивании посвящено большое количество работ [26-36]. Проанализировав имеющиеся в различных литературных источниках данные можно установить следующие особенности окисления сульфидов металлов: При дефиците окислителя и высоких температурах и концентрации кислоты (например, кислотное растворение моносульфидов железа, цинка) в раствор переходят металлы в форме соответствующих солей, а сера в газовую фазу: MeS + 2Н+ - Ме2+ + H2S (1.1)
При наличии слабокислых или комплексообразующих растворителей, окислителя и при высокой температуре в раствор переходят и металл, образующий растворимые соединения в данной среде, и сера: MeS + 202 - Ме2+ + S042 (1.2) MeS + n02 + xNH3 - [Me(NH3)x]2+ + S02n2 (1.3) При высокой кислотности (pH 1,0), температуре не более 420К и наличии окислителя в раствор переходят растворимые металлы, а сульфидная сера окисляется до элементной: MeS + 2ЇҐ + 0,5О2 - Ме2+ + S + Н20 (1.4)
Элементная сера при Т 390 К, находясь в расплавленном состоянии, смачивает поверхность сульфидов, затрудняя дальнейшее развитие процесса; негативное влияние расплава серы устраняется при введении поверхностно-активных веществ; элементная сера при Т 420 К заметно окисляется до сульфат-иона. Соотношение и выход серосодержащих форм при окислении сульфидной серы определяются величиной окислительного потенциала, который, в свою очередь, зависит от концентрации растворенного окислителя, температуры, интенсивности массообмена в системе, наличия катализаторов, типа растворителя (среды). При этом элементарная сера легче всего образуется при окислении пирротина, пентландита и кобальтина. Из сульфидов меди и цинка элементарная сера образуется лишь при работе в кислых средах. Для получения серы из пирита требуются низкие температуры и давления кислорода, а также высокая кислотность; в остальных случаях при окислении пирита образуется сульфат-ион.
Окисление сульфидов ускоряется в присутствии ионов переменной валентности (Cu2+, Fe3+, Мп4+ и др.), которые проявляют окислительные способности, а при наличии растворенного кислорода регенерируются;
В процессе окисления сульфидов возможны сопряженные реакции, приводящие к образованию экранирующих пленок (промежуточные сульфиды, гидратированные оксиды, основные сульфаты, нерастворимые сульфаты металлов и др.). Нерастворимые пленки на поверхности сульфидов формируют пассивное их поведение; если скорость образования пленок превышает скорость их растворения, то выщелачивание извлекаемого металла или существенно замедляется, или прекращается (важными факторами являются диффузионная проницаемость пленки, сплошность экранирования ею исходного сульфида);
Заметна роль компонентов пустой породы, содержащихся в сульфидах: возрастает расход растворителя, образуются новые фазы, вызывающие вторичные потери растворенного металла или дополнительные диффузионные осложнения;
Окисление сульфидов в водных средах протекает с большим выделением тепла, особенно при образовании сульфат-иона (в 3-4 раза больше, чем для реакций, завершающихся образованием элементной серы);
Химически чистые моносульфиды растворяются с меньшей скоростью, чем их природные аналоги; в последних неизбежно присутствуют примеси, тип и концентрация которых вносят искажения в стехиометрию, упорядоченность кристаллической решетки. При совместном присутствии сульфидов скорость окисления их различна; более растворимые из них из-за проявления гальванического эффекта выполняют роль «протектора»; 7) В присутствии ионов свинца, меди, серебра при соответствующих температурах, кислотности, обеспечивающих количественный гидролиз ионов Fe(III), происходит образование поликомпонентных осадков ярозитового типа PbS04 + 3Fe2(S04)3 + 12Н20 - PbFe6(S04)4(OH)i2 + 6H2S04 (1.5) PbS04 + CuS04 + Fe2(S04)3 + 5H20 - PbOCuOFe203S03H20 + 4H2S04 (1.6) По указанным процессам попадают в состав ярозитных осадков и сульфаты серебра, индия, таллия. Это приводит к дополнительным потерям цветных металлов с отвальными железосодержащими кеками и существенно осложняет их доизвлечение;
При повышенных температурах в отсутствие кислорода происходит взаимодействие, например, сульфата меди (II) с сульфидами других менее халькофильных, чем медь, металлов: MeS + Cu2+ - Ме2+ + CuS, где Me - Zn, Fe, Ni и др. (1.7) Этот процесс получает развитие при 440-470 К, кислотности не более 0,1М, при этом осаждающая активность сульфидов возрастает в ряду FeS2 - ZnS - CuS - PbS - CuFeS2 - FeS. Скорость окисления сульфидов в начальный момент соответствует топохимической модели уменьшающегося (сжимающегося) ядра которая предполагает, что взаимодействие вещества с внешним реагентом (химическая реакция) происходит только на поверхности частицы. Зона реакции постепенно продвигается внутрь частицы, оставляя за собой превращенный продукт и инертную часть частицы. В ходе реакции ядро частицы, содержащее активный еще не прореагировавший компонент, постепенно уменьшается.
Однако, со временем, вид кинетических графиков отклоняется от прямолинейного, что совпадает с началом формирования пленок поверхностных фаз (конгломератов «сульфид + сера элементная», низших сульфидов, гидроксидов железа и др.). В результате снижалась активная поверхность окисляемого исходного сульфида. Роль развивающихся поверхностных реакций в механизме процесса становится определяющей, о чем свидетельствуют и высокие значения энергий активации (до 40-60 кДж/моль).
Определение кажущейся энергии активации по классическому методу
Цель экспериментального изучения кинетики выщелачивания состоит в определении зависимости скорости процесса от основных технологических параметров - температуры и концентрации реагентов и установлении лимитирующей стадии, что необходимо для поиска оптимальных условий выщелачивания.
При изучении кинетики экспериментально определяют зависимость степени выщелачивания от его продолжительности при различных условиях (температуре, концентрации реагентов). Основными кинетическими характеристиками выщелачивания являются: энергия активации процесса (Еа); порядок реакции по кислороду (п).
Известно, что процесс окисления минерала кислородом состоит из нескольких этапов: 1) абсорбция 02 раствором; 2) молекулярная диффузия 02 к твёрдой частичке; 3) молекулярная диффузия 02 внутри твёрдой частички к сульфиду; 4) химическое взаимодействие 02 с сульфидом, которое в свою очередь может состоять из нескольких стадий; 5) отвод продуктов; также может состоять из нескольких этапов.
В установившемся процессе, согласно материальному балансу, скорости каждого этапа равны между собой, и равны скорости выщелачивания: V=Ui=u2=U3=U4=U5- Если один из этапов (n-ный) значительно медленнее других, то он и определяет скорость всего процесса.
Если выщелачивание лимитируется одной из трех первых стадий (диффузионные ограничения), то скорость процесса зависит от концентрации кислорода в первой степени и мало зависит от температуры (Еа 40 КДж/моль). Если лимитирующая стадия - химическое взаимодействие, то процесс имеет отличающийся от единицы порядок по кислороду (дробный или больше единицы) и сильно зависит от температуры (Еа 40 КДж/моль). Если же самая медленная стадия - отвод продуктов, то порядок выщелачивания по кислороду должен быть нулевым.
Для расчета кажущихся энергии активации и порядка по кислороду необходимо провести несколько серий опытов при соблюдении следующих обязательных условий:
1. Для изучения кинетических характеристик следует выбрать такие интервалы изменения основных параметров процесса, которые в наибольшей степени соответствуют условиям реального автоклавного выщелачивания. Проба исходного сырья тоже должна быть представительной по химическому, фазовому и гранулометрическому составу.
2. В ходе экспериментов необходимо выявить влияние каждого из существенных параметров процесса, таких как температура, парциальное давление кислорода, возможно - добавка какого-либо реагента, крупность исходного сырья и т.д. Для этого зависимость степени окисления сульфидов от времени выщелачивания определяют при З-х-4-х значениях каждого параметра, фиксируя при этом остальные.
3. Условия окисления должны исключать возникновение внешнедиффузионных ограничений. Это условие означает, что перемешивающее устройство автоклава должно обеспечивать не только равномерность содержания твердой фазы во всем объеме пульпы, но и максимально возможную при данных условиях концентрацию растворенного кислорода в жидкой фазе пульпы.
Кажущуюся энергию активации Еа проще всего рассчитать в том случае, если отношение скоростей выщелачивания представлено как функция одной переменной - температуры при постоянстве всех остальных параметров процесса (начальных концентраций реагентов, количества, крупности и формы частиц выщелачиваемого материала, интенсивности перемешивания и др.). В основу расчета энергии активации положено уравнение: т(Т2,аО К(Т2) RVT4 Т2У Д1пт(а,) = І А (і) (2.1) где т - время выщелачивания, сек; (ХІ - степень выщелачивания компонента за ТІ, доля единицы; Т - температура выщелачивания, К; Е - кажущаяся энергия активации процесса, Дж/моль; R - универсальная газовая постоянная Дж/(моль-К). Выражение (2.1) - уравнение прямой в координатах 1п(т) - 1/Т; тангенс угла наклона прямой равен E/R. Таким образом, для определения кажущейся энергии активации процесса необходимо: 1) Найти зависимость степени выщелачивания от его продолжительности для нескольких температур и построить соответствующие графики в координатах а - т; 2) Найти непосредственно из графиков а(т) продолжительность выщелачивания, необходимую для достижения о ; 3) Построить график зависимости 1п(т) - 1/Т (Рисунок 2.6) и рассчитать Еа.
Для определения кажущегося порядка процесса по одному из реагентов необходимо экспериментально изучить зависимость степени выщелачивания от его продолжительности при различных концентрациях данного реагента и постоянных температуре и концентрациях остальных реагентов. При этом отношение концентраций реагента не должно зависеть от степени выщелачивания, что выполняется, если во всех опытах имеется большой избыток реагента При необратимой реакции при любой степени выщелачивания справедливо соотношение кажущийся порядок по реагенту можно найти как тангенс угла наклона прямой в координатах lg(x) - lg(C0): Algx = -nAlgC0 (2.2) Последовательность действий при определении кажущегося порядка реакции по одному из реагентов аналогична действиям при нахождении кажущейся энергии активации.
Результаты экспериментов и их обсуждение
Предлагаемая гидрометаллургическая технология переработки медно-цинковых сульфидных концентратов предусматривает перевод цинка в раствор. Получаемые цинковые растворы содержат, в зависимости от состава исходных концентратов, 20-25 г/л цинка, а также значительное количество железа и серной кислоты. Данные растворы бедны для прямого извлечения цинка электролитическим методом, поэтому должны проходить стадию концентрирования.
Одним из путей возможного концентрирования является упаривание растворов, однако, этот метод экономически невыгоден из-за больших затрат энергоресурсов.
Осаждение цинка может быть произведено в твердый продукт известняком. Данный способ требует предварительной очистки раствора от железа, при этом необходимо перевести железо в трехвалентную форму и что позволяет выделить его из раствора в виде гидроксосульфатов различной модификации [95]. Кроме того при этом получаются твердые продукты, содержащие цинк в виде гипсокарбонатов и гипсогидратов цинка, что приводит к получению бедного (цинка в осадке не более 15-20%) высокожелезистого продукта, дальнейшая переработка которого до товарного продукта технически затруднена и экономически нецелесообразна [96].
Наиболее приемлемый метод переработки растворов в технологии обогатительной фабрики - это осаждение цинка в виде твердого сульфидного цинкового продукта. Этот метод наиболее выгоден как с точки зрения получения транспортабельного продукта, так и с точки зрения пригодности этого продукта для дальнейшей реализации [97]. При введении в сернокислый раствор сульфидсодержащего агента (H2S, NaHS) образуется сероводородная кислота, которая диссоциирует:
В работе [98] была исследована зависимость концентрации растворенного сероводорода от рН раствора при остаточной концентрации меди, цинка, никеля, железа, равной 0,01 г/л. Показано, что сульфид меди можно осадить во всем диапазоне рН, сульфид цинка интенсивно начинает осаждаться при рН выше единицы, сульфид закисного железа - при рН выше четырех. Оптимальными условиями осаждения цинка является область рН = 2-2,4, ниже этой области происходит интенсивное выделение сероводорода, выше повышенное соосаждение железа. Результаты экспериментов по концентрированию цинка из растовров и их обсуждение
В качестве сульфидсодержащего реагента выбран нами раствор гидросульфида натрия. Гидросульфид натрия - NaHS является широко распространённым реагентом используемый на обогатительных фабриках, применяются в качестве активатора - сульфидизатора при флотации окисленных минералов и вторичных сульфидов меди и цинка. Количество задаваемого NaHS рассчитывали согласно стехиометрии химических реакций (4.1), (4.2).
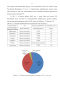
Раствор гидросульфида натрия вводили в донную часть реактора с целью уменьшения выделения H2S в атмосферу при перемешивании, Т=20-25С, время осаждения - 10 минут. На рисунке 4.1 представлена зависимость степени осаждения цинка и железа от величины стехиометрического расхода NaHS.
Таким образом, получены следующие условия операции осаждения, обеспечивающие извлечение в твердый продукт Zn 99-100%, Fe 5%: время осаждения 5 мин., расход NaHS 100-105% от стехиометрического, температура 20-25С.
При выбранных параметрах была проведены исследования по осаждению применительно к реальному раствору после автоклавного выщелачивания низкосортного концентрата Ново-Шемурского месторождения. Состав раствора приведен в таблице 4.2. Таблица 4.2 - Состав раствора после автоклавного выщелачивания Содержание, г/л рН Си Zn Cd еобщ 1,57 19,4 0,0412 33,8 0,85 На основе литературных данных по оптимальной области рН осаждения цинка и для снижения расхода гидросульфида натрия за счет удаления ионов Fe3+ необходимо провести предварительную нейтрализацию пульпы.
В качестве нейтрализатора применяли известь (СаОакт=80%). Известь вводили в пульпу в виде известкового молока с содержанием твердого 10% (масс). Нейтрализацию вели до рН=3,0 для полного удаления ионов Fe . В таблице 4.3 дана характеристика продуктов предварительной нейтрализации. Таблица 4.3 - Характеристика продуктов предварительной нейтрализации
Опыты, проведенные на реальном растворе, подтверждают данные полученные применительно к синтетическому раствору; получен сульфидный кек, с извлечением цветных металлов более 99%. При проведении предварительной цементации меди, полученный сульфидный кек является товарным цинковым концентратом высшей марки КЦ-0 [99]. Раствор после осаждения цветных металлов направляется на станцию нейтрализации ОФ, либо может использоваться как раствор на орошение для кучного и отвального выщелачивания отвалов обогатительных фабрик [100]. 4.2 Разработка технологической схемы автоклавного кондиционирования низкосортных медных концентратов
На основании проведенных лабораторных исследований и полученных данных экспериментальных данных разработана и предложена технологическая схема автоклавного кондиционирования низкосортного сульфидного медного концентрата (Рисунок 4.3).
Принципиальная технологическая схема автоклавного кондиционирования низкосортного сульфидного медного концентрата Разработанная технологическая схема включает в себя следующие основные операции: приготовление пульпы медного концентрата, с определенным отношением Ж/Т и загрузка ее в автоклав: автоклавное окислительное выщелачивание медного концентрата (удельный расход кислорода -250 лн/кг к-та, Т 180С, Р(О2) 0,4 МПа) в горизонтальном автоклаве, с получением высококачественного медного концентрата - II и железо-цинкового раствора; промежуточная нейтрализация раствора известковым молоком с выводом железо-гипсового кека; цементация меди на железный скрап в конусных цементаторах, с получением цеметационной меди. осаждение цинка и кадмия из обезмеженного раствора серосодержащим реагентом, с получением высококачественного цинкового концентрата.
Результаты экспериментов по концентрированию цинка из растовров и их обсуждение
По обоим методам получены близкие результаты, что позволяет сделать вывод о достоверности полученных данных. Высокие значения величины кажущейся энергии активации свидетельствуют о протекании процесса окисления сфалерита в кинетической области, скорость процесса лимитируется скоростью протекания химической реакции [85,86]. Это также подтверждается дробными значениями кажущегося порядка реакции по кислороду, что соответствует протеканию процесса в кинетической области, и особенно - снижением порядка по кислороду с 0,94 -0,98 до 0,66 -0,68 при повышении температуры процесса.
При расчете уравнений (2.3), (2.4), (2.5) по модели «сжимающегося ядра» і наиболее достоверно описывает процесс зависимость вида 1 — (1 — а) з = f(x). Это подтверждает вывод о протекании процесс окисления сфалерита в кинетической области. Процесс описывается механизмом со свободным выносом продуктов реакции в раствор без диффузионных сопротивлений, связанных с образованием каких-либо пленок на поверхности материала.
В изученной пробе флотационного концентрата медноколчеданной руды Ново-Шемурского месторождения медь представлена халькопиритом и ковеллином, цинк находится в форме сфалерита, железо присутствует трех фазах: халькопирите, пирите и пирротине. Концентрат отличается равномерным распределением основных минеральных фаз цветных металлов и железа по выделенным классам крупности. Количество породообразующих минералов не превышает 2%. Учитывая характер и особенности минерального состава флотационного концентрата, повышение его качества исключительно методами механического обогащения затруднительно.
Определение кинетических характеристик процесса автоклавного обесцинкования флотационного концентрата (температура 140-200 С, давление кислорода 0,2-0,6 МПа) классическим методом и по модели «сжимающегося ядра» дают практически идентичные результаты: значения кажущейся энергии активации окисления сфалерита находятся в интервале 69,5-74,15 кДж/моль; порядок реакции по кислороду - в интервале 0,66-0,98. Значения кажущейся энергии активации и кажущегося порядка реакции по кислороду свидетельствуют о протекании процесса автоклавного окисления сфалерита в кинетической области; скорость процесса лимитируется скоростью протекания химической реакции. Согласно кинетическим расчетам по модели «сжимающегося ядра» процесс автоклавного выщелачивания цинка описывается механизмом со свободным выносом продуктов реакции в раствор без диффузионных сопротивлений. Автоклавное выщелачивание цинка из низкокачественного медного концентрата Ново-Шемурского месторождения в диапазоне температур 180-200С и парциальном давлении кислорода 0,4-0,6 МПа сопровождается практически полным окислением сфалерита и переходом цинка в сульфатный раствор.
Наиболее сложной задачей при проведении автоклавного окислительного выщелачивания является максимально полное растворение кислорода в жидкой фазе пульпы, что достигается применением эффективного перемешивания. Скорость растворения кислорода в конечном счете определяет производительность автоклава, а это, в свою очередь, объем капитальных затрат на весь автоклавный передел. Количественным критерием интенсивности аэрации перемешивающего устройства является сульфитное число (Ks), которое может быть экспериментально установлено для любого аппарата.
Методика определения сульфитного числа перемешивающего устройства использует химическую реакцию окисления сульфита натрия кислородом: Na2S03 + Vi 02 = Na2S04 (3.1) Скорость самой химической реакции (3.1) весьма высока, поэтому обычно она ограничена концентрацией растворенного кислорода. При сохранении стабильных условий окисления, таких как температура раствора, исходная концентрация сульфита натрия, давление кислорода, коэффициент заполнения автоклава раствором, и т.д. скорость реакции окисления определяется числом оборотов мешалки. «Сульфитным числом» называют удвоенное количество молей кислорода поглощенное за час одним литром раствора сульфита натрия при парциальном давлении кислорода, равном 1 атмосфере.
Подача кислорода в автоклав в жидкую фазу осуществлялась по заглубленной в жидкость трубке, расположенной в непосредственной близости от перемешивающего устройства. Подачу и регулирование расхода газа в автоклав осуществляли с ПК с помощью системы контроля и регулирования давления «Bronkhorst». Об окончании реакции свидетельствовало отсутствие расхода кислорода. Условия проведения опытов:
Методика опытов по автоклавному выщелачиванию заключалась в следующем. Навеску исследуемого (Таблица 2.1) флотоконцентрата распульповывали в воде и переносили в автоклав. Исходное Ж:Т во всех опытах составляло 4:1 Автоклав герметизировали и нагревали до заданной температуры. По достижении рабочей температуры начинали подачу кислорода и фиксировали время начала автоклавного выщелачивания. В течение опыта температуру в автоклаве поддерживали постоянной с точностью ±1 градус. По истечении заданного времени выщелачивания автоклавную пульпу охлаждали и сбрасывали давление до атмосферного. Фильтрат (без промывных вод) анализировали на Си, Zn, Feo6ni., твёрдую фазу - на Zn, Си, Fe, Pb.