Содержание к диссертации
Введение
Глава 1. Литературный обзор 9
1.1. Распространенность диабетической нефропатии 9
1.2. Патогенез диабетической нефропатии 10
1.3. Классификация и характеристика стадий диабетической нефропатии 14
1.4. Профилактика и терапия диабетической нефропатии 26
Глава 2. Материалы и методы исследования 31
2.1. Контингент обследованных детей 31
2.2. Методы исследования 35
2.3. Статистические методы исследования 43
Глава 3. Количественная и качественная характеристика протеинурии в динамике сахарного диабета 1 типа у детей 47
Глава 4. Функциональное состояние мочевой системы при сахарном диабете 1 типа у детей 58
Глава 5. Прогностические критерии поражения почек при сахарном диабете 1 типа у детей 72
Глава 6. Оценка эффективности ингибиторов ангиотензинпревращающего фермента при сахарном диабете 1 типа у детей 84
Глава 7. Заключение 92
Вывоы 108
- Распространенность диабетической нефропатии
- Классификация и характеристика стадий диабетической нефропатии
- Контингент обследованных детей
- Статистические методы исследования
Введение к работе
Актуальность темы.
В настоящее время одной из наиболее актуальных проблем как взрослой, так и детской эндокринной патологии является сахарный диабет (СД), с учетом быстрого роста заболеваемости и развития осложнений, приводящих к инвалидизации или укорачивающих жизнь пациентов [7, 29, 35]. По данным ВОЗ, число заболевших диабетом в мире удваивается каждые 10-15 лет, а продолжительность жизни больных остается ниже, чем в общей популяции [6, 97].
Для пациентов, заболевших диабетом в детском возрасте эта проблема наиболее актуальна, так как у детей сахарный диабет 1 типа (СД 1 типа) протекает лабильно, с частыми декомпенсациями, что может способствовать более раннему развитию осложнений, таких как микроангиопатия [56, 72, 116].
Тяжелые специфические осложнения, приводящие к снижению трудоспособности, ухудшающие прогноз жизни больного, сделали СД 1 типа важнейшей медико-социальной и экономической проблемой современного общества [71, 83].
Особый интерес среди грозных осложнений СД 1 типа представляет поражение почек, а именно диабетическая нефропатия (ДН), так как является одной из основных причин летальности среди этого контингента больных [25, 98]. ДН развивается в основном через 5-10 лет от начала болезни, значительно ухудшает качество жизни больного, способствует его инвалидизации и достаточно быстро приводит к хронической почечной недостаточности (ХПН) - каждый четвертый-пятый больной СД 1 типа умирает от ХПН [25, 35]. Лечение терминальной почечной недостаточности экстракорпоральными методами (диализ, трансплантация почки) ежегодно требует колоссальных капиталовложений, доходящих до нескольких
миллиардов долларов, что ставит проблему патологии почек при диабете в ранг важнейших социально-экономических проблем [7, 23].
Лейтмотивом современных подходов в борьбе с осложнениями является превентивная тактика, т.е. стремление специалистов любыми средствами предупредить или остановить на ранних стадиях уже начавшийся патологический процесс [65]. В соответствии с вышеизложенным чрезвычайную актуальность приобретают вопросы ранней диагностики ДН у детей. При выявлении маркеров начального поражения почек своевременное подключение корригирующей терапии способствует отдалению сроков клинического проявления данного осложнения или даже предупреждает его развитие, что улучшает качество жизни детей с СД 1 типа, продлевает период трудоспособности больных в более зрелом возрасте и, главное, улучшает прогноз заболевания [93, 108, 116].
Таким образом, определение ранних (доклинических) маркеров поражения почек у детей с СД 1 типа и своевременное подключение корригирующей терапии приобретает большую медицинскую, социальную и экономическую значимость [23, 90]. Цель работы.
Целью данной работы явилось выявление ранних признаков поражения почек при СД 1 типа у детей и оценка эффективности ренопротективной терапии. Для достижения намеченной цели были поставлены следующие задачи:
Изучить частоту регистрации, количественный и качественный состав протеипурии в динамике СД 1 типа у детей.
Установить функциональные характеристики почек при СД 1 типа у детей.
Выявить прогностические факторы развития ДН у детей с учетом анализа анамнеза, клинических и лабораторных характеристик.
7
4. Оценить ренопротективную эффективность ингибиторов
ангиотензинпревращающего фермента (и-АПФ) у детей с ДН при СД 1
типа. Научная новизна работы.
Впервые проведен комплексный анализ состояния мочевой системы в динамике СД 1 типа у детей.
Новым являются данные по различным типам уропротеинограммы (УПГ) и ее изменению с учетом стажа заболевания.
Указаны сроки появления протеинурии, микроальбуминурии (МАУ) и ее «патологических» типов у детей с СД 1 типа, установлены изменения не только со стороны гломерулярной, но и тубулярной системы почек.
Определены сроки изменения функциональных характеристик почек — функции фильтрации, функционального почечного резерва (ФПР), функции концентрирования и почечной гемодинамики с учетом длительности заболевания.
При проведении корреляционного анализа установлены четкие связи с показателями мочевой системы, которые увеличивались при большем сроке болезни - с 5 (при стаже диабета 3,96±0,23 лет) до 11 - при длительности заболевания более 6 лет.
Научную новизну работе придают и выявленные неблагоприятные прогностические факторы развития и прогрессирования ДН: старший возрастной контингент детей, мужской пол, увеличение индекса массы тела (ИМТ), повышение систолического (САД) и диастолического артериального давления (ДАД), повышение холестерина, повышение Р-липопротеидов (|3-ЛП), снижение удельного веса мочи и снижение скорости клубочковой фильтрации (СКФ).
Впервые установлено благоприятное влияние и-АПФ на количественный и качественный состав протеинурии при СД 1 типа у детей.
8 Практическое значение работы.
Для диагностики ранних, доклинических стадий ДН необходим комплексный анализ параметров, характеризующих состояние мочевой системы, таких как: СКФ, ФПР, удельный вес мочи, почечный кровоток, протеинурия, МАУ и УПГ.
Факторами риска развития ДН являются: старший возрастной контингент детей, мужской пол, увеличение ИМТ, повышение САД, повышение ДАД, повышение холестерина, повышение (3 - ЛП. О прогрессировании ДН можно думать при снижении удельного веса мочи и снижении СКФ.
Рекомендуется применение и-АПФ у детей с СД 1 типа при появлении протеинурии или МАУ и/или «патологических» типах УПГ. Публикация результатов исследования. По материалам выполненных исследований опубликовано 5 работ в центральной и местной печати, 1 работа принята для публикации в журнал, рекомендуемый ВАК. Объем и структура диссертации.
Диссертация изложена на 130 страницах машинописного текста и состоит из введения, обзора литературы, описания материалов и методов исследования, 4-х глав собственных наблюдений, заключения, выводов, практических рекомендаций, списка литературы. Иллюстративный материал представлен 44 таблицами, 5-ю рисунками и 1-й схемой. Список литературы включает 199 источников, из которых 100 отечественных и 99 зарубежных.
Распространенность диабетической нефропатии
Одним из самых уязвимых органов при СД является почка. Поражение почек у больных СД является причиной смерти значительно чаще, чем другие висцеральные поражения [3, 6, 106].
Частота выявления ДН находится в тесной зависимости от длительности сахарного диабета. Так у больных со стажем диабета 1 типа до -10 лет она составляет 5-6 %, до 20 лет— 20-25 %, до 30 лет - 35-40 %, до 40 лет - 45 %. При длительности заболевания более 35-40 лет, если нефропатия еще не развилась, то вероятность ее возникновения крайне мала (не превышает 1 % случаев в год), что свидетельствует об определенной защищенности этих пациентов (возможно генетической) от патологического воздействия метаболических факторов на почки [12, 79, 118, 147]. Максимальный пик развития ДН приходится на сроки от 15 до 20 лет существования СД 1 типа [23, 25, 54]. Общепринято, что в первые 5 лет от начала СД 1 типа ДН (даже самая ранняя ее стадия - стадия МАУ) не развивается. Однако в последние годы этот тезис получил опровержение. По данным исследования EURODIAB, в котором изучалась частота развития ДН в 26 различных центрах Европы, МАУ была выявлена у 18% больных СД 1 типа с длительностью заболевания менее 5 лет. Более выраженная стадия ДН - стадия протеинурии - крайне редко развивается в сроки до 5 лет от начала СД 1 типа [22, 59, 102].
Частота развития ДН при СД 1 типа также зависит от возраста, в котором дебютировало заболевание. Так, частота выявления ДН значительна (44-45%) у пациентов с развитием диабета в детском и пубертатном возрасте, т.е. до 20 лет, снижается до 30-35% при дебюте диабета после 20 лет и не превышает нескольких процентов при дебюте заболевания после 35 лет. Предполагают, что эти возрастные различия в частоте развития ДН связаны с патологическим воздействием на почки гормональной перестройки организма во время пубертата (активной секреции гормона роста, половых гормонов, которые оказывают контринсулярное действие), и связанной с этим худшей компенсацией углеводного обмена и метаболических нарушений в этот период [5, 28, 107].
В развитых странах мира за последние годы наметилась тенденция к снижению частоты развития ДН при СД 1 типа. Несомненно, причины этой тенденции кроются в более тщательном, качественном контроле нарушений углеводного обмена и раннем начале терапии ДН. С учетом вышеизложенного становится насущно необходимым установление ранних маркеров поражения почек при ДН у детей и подростков [56, 90, 112].
Механизм повреждения любого органа (в том числе и почек) или системы схематически можно представить в виде взаимодействия нескольких процессов. Всегда существует некая пусковая причина, инициирующая начальные изменения, которые, как правило, носят функциональный характер. В последующем, если причина поражения устранена, начальные изменения могут подвергнуться обратному развитию за счет включения компенсаторных и адаптивных реакций. Однако, если причина продолжает воздействовать на орган - "мишень", то в данном случае, те компенсаторные процессы, которые включаются для восстановления нормального функционирования органа, перестают оказывать благоприятное воздействие и, напротив, становятся факторами прогрессирования патологии органа. В свою очередь, факторы прогрессирования оказывают свое повреждающее воздействие на орган - "мишень" посредством «медиаторов» прогрессирования, т.е. тех непосредственных агентов (веществ), которые повреждают орган на уровне клетки. Генетически закодированная предрасположенность или устойчивость к развитию заболевания способна соответственно либо ускорять, либо тормозить прогрессирование патологии [23, 62, 137].
В последнее время патогенез ДН представляется как многофакторный процесс, включающий метаболические, гормональные и генетические составляющие [35, 36, 115].
По мнению многих авторов, основной механизм поражения почки при СД - это нарушение ауторегуляции почечного кровотока, повышение фильтрационной нагрузки на почечные клубочки, развитие внутриклубочковой гипертензии и гиперфильтрации [120, 121].
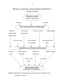
Тем не менее, процесс развития ДН также можно представить в виде каскада взаимодействий между пусковой причиной, факторами прогрессирования и «медиаторами» прогрессирования почечной патологии (схема 1). Пусковой причиной, вызывающей сосудистые осложнения СД, является гипергликемия. Гипергликемия активирует действие факторов прогрессирования патологии почек (внутриклубочковой гипертензии, системной гипертензии, гиперлипидемии), которые вызывают повреждение почек на уровне клетки посредством «медиаторов» прогрессирования, таких как факторы роста, вазоактивные факторы, цитокины и др. [132, 139]. Взаимодействие всех вышеперечисленных факторов происходит под «генетическим» контролем, определяющим большую или меньшую чувствительность почек к воздействию патологических агентов [62, 155, 174].
Классификация и характеристика стадий диабетической нефропатии
По мере совершенствования методик исследования функционального состояния почек, а также расширения возможностей анализа морфологических изменений почечной ткани на светооптическом и ультраструктурном уровнях разработаны механизмы формирования ДН и стадии ее развития [23, 35].
Наиболее детально классификация ДН разработана СЕ. Morgensen в 1983 году (таблица 1):
Как следует из таблицы, протеинурия - первый клинический признак патологического процесса в почках - появляется лишь на IV стадии развития ДН [109, 142]. Первые же три стадии протекают бессимптомно и клинически не выявляются. Эти три стадии и составляют, так называемый, «доклинический» период в развитии ДН. Все выявляемые в это период изменения (гиперфильтрация, гиперперфузия почек, микроальбуминурия) не могут быть обнаружены при рутинном обследовании пациентов и требуют применения специальных методик [54, 70].
По мнению многих авторов, только первые три стадии ДН (бессимптомные), возможно, могут быть обратимыми при тщательной и рано начатой коррекции гипергликемии, когда нормализуются внутрипочечная гемодинамика и объем почек, исчезает МАУ, и даже подвергаются обратному развитию структурные изменения клубочков [60, 116]. Появление же протеинурии свидетельствует о том, что патологический процесс принял необратимый характер [28, 35, 105] .
Эта стадия характеризуется появлением первых функциональных нарушений в работе почек, которые клинически никак не проявляются.
Однако при детальном изучении функционального состояния почек можно выявить начальные изменения. Самые ранние функциональные нарушения со стороны почек при СД обнаруживаются уже в дебюте заболевания [82, 85]. Эти изменения характеризуются развитием, так называемой, гиперфильтрации, т.е. повышением скорости клубочковой фильтрации (СКФ) выше нормальных значений ( 140 мл/мин), и гиперперфузии почек, т.е. увеличенным почечным кровотоком [36, 172].
Установлено, что у больных СД 1 типа в первые недели-месяцы после появления гипергликемии СКФ повышается на 20-40 % по сравнению с нормой. Повышение СКФ в дебюте диабета, безусловно, связано с реакцией почек на стойкую гипергликемию. При этом, чем выше уровень глюкозы, тем
выше СКФ. Однако такая прямая зависимость между гликемией и СКФ сохраняется только при умеренно высоких значениях сахара крови (до 13-14 ммоль/л); при более высоком уровне гликемии СКФ начинает линейно снижаться [22, 35, 172].
Хорошая компенсация углеводных нарушений (которая достигается инсулинотерапией и диетой) приводит к нормализации СКФ [65, 76, 123]. Однако у 25% больных СД 1 типа даже идеальный метаболический контроль сопровождается лишь незначительным снижением СКФ, оставаясь на высоком уровне на долгие годы вплоть до появления протеинурии. По мнению многих авторов, данную категорию больных целесообразно относить к группе высокого риска в отношении будущего развития клинической стадии ДН [28, 105, 167].
Среди причин появления стойкой гиперфильтрации при диабете 1 типа многие исследователи [146, 167, 168] рассматривают различные гормонально-метаболические факторы: 1. Гипергликемия; 2. Гиперкетонемия; 3. Гиперпродукция гормона роста и глюкагоиа; 4. Нарушение баланса простаглаидинов; 5. Гиперпродукция предсердного натрийуретического пептида; 6. Гиперпродукция эндотелиального фактора релаксации (оксида азота - NO); 7. Нарушенная тубуло-гломерулярная обратная связь; 8. Высокое потребление белка.
Таким образом, гиперфильтрация является результатом совокупного воздействия различных гормонально-метаболических факторов, вклад каждого из которых невелик, но их сочетанное воздействие приводит к выраженной гиперфункции клубочка (рисунок 1) [23, 177, 179].
Контингент обследованных детей
Обследовано 186 детей, страдающих СД 1 типа - 93 мальчика и 93 девочки, из них 90 пациентов (48,39 %) - жители области и 96 (51,61 %) -жители города. Возрастной контингент обследуемых составил от 4,08 лет до 18,0 лет, средний возраст — 13,81±2,85 лет. Стаж заболевания - от впервые выявленного до 16 лет, средняя продолжительность болезни — 4,94±3,27 лет. Дети наблюдались проспективно в течение 4-х лет, а также ретроспективно до 2003 года.
Течение основного заболевания
У 71 пациента был семейный тип диабета (38,17 %), у 115 -спорадический (61,83 %). У 22 детей (11,83 %) заболевание протекало лабильно, с декомпенсациями более 2-х раз в году, у остальных -относительно стабильно - с декомпенсациями 2 и менее раз в году. В анамнезе у 19 больных (10,21 %) были комы: в 16 случаях кетоацидотическая и в 3-х - гипогликемическая. У 8 пациентов кетоацидотическая кома зарегистрирована в дебюте СД; в остальных случаях - при стаже диабета от 1 до 9 лет, у 3-х пациентов из этой группы она отмечалась дважды.
При поступлении в стационар все дети находились в стадии декомпенсации углеводного обмена, в 19,36 % случаев у пациентов отмечался кетоз. Уровень гликозилированного гемоглобина (HbAlc) при поступлении в стационар составлял от 3,8% до 22,4%, в среднем - 12,16±3,57
На момент проведения специальных методов исследования ни у кого из обследованных пациентов кетоза не было. Уровень среднесуточной гликемии по данным суточного гликемического профиля составлял от 2,5 до 28,1 ммоль/л, среднее значение 13,29±4,8 ммоль/л. Терапия
Все больные получали генно-инженерные человеческие инсулины в базис — болюсном режиме, который позволяет с максимальной точностью имитировать физиологическую секрецию гормона. Использование данного режима подразумевает введение инсулина короткого действия 3 раза в день перед основными приемами пищи и пролонгированного инсулина 2 раза (или 1 раз — при использовании инсулина сверхдлительного действия) в день — перед завтраком и ужином (или перед сном). При этом режиме введение пролонгированного инсулина приближается к физиологическому фону секреции («фоновый» или «базальный» инсулин), а введение короткого -характеризует выход гормона в ответ на прием пищи («пищевой», «стимулированный» или «болюсный» инсулин»).
Инъекции инсулина производились специальными индивидуальными инсулиновыми шприцами (Novo-pen-2,3) в подкожно-жировую клетчатку. Основные места введения - область живота, бедра, ягодицы, плечи. Коррекция дозы инсулина осуществлялась, исходя из показателей гликемического и глюкозурического профилей.
Потребность в инсулине определялась из расчета суточной дозы инсулина на килограмм массы тела, при выписке больного из стационара, в стадии относительной или полной клинико-лабораторной компенсации. Суточная доза инсулина у обследованных детей составила от 6,2 до 82 ЕД/сут (в среднем 43,97± 15,23 ЕД/сут), а потребность 0,27 — 1,67 ЕД/кг в сутки (в среднем 0,93±0,21 ЕД/кг в сутки).
Кроме инсулинотерапии дети получали следующие группы препаратов: ноотропы (пирацетам, фезам, пантогам); средства, улучшающие мозговое кровообращение (винпоцетин, циннаризин); поливитамины; витамины группы В; гиполипидемические и липотропные средства (холестирамин, липоевая кислота); ферменты; антибактериальные препараты. Ингибиторы АПФ получали 49 пациентов - эналаприл, моноприл, рамиприл - в дозировке от 2,5 до 10 мг/сут в 1-2 приема, длительность применения от 1 месяца до 1,5 лет.
С учетом длительности СД при анализе проведенных исследований, нами были выделены следующие группы больных (таблица 2):
Статистические методы исследования
Статистическая обработка результатов исследований проводилась на ПЭВМ Pentium (R) 4 - 3,00 GHz, с помощью пакетов программ Excel 2003, пакета Stat Soft Statistica for Windows ver. 6.0 компании SPSS Inc., с использованием параметрических и непараметрических критериев. Для сбора первичных данных был создан первичный модуль в среде программы Stat Soft Statistica.
Ниже приведено описание основных использованных в работе статистических инструментов.
Описательная статистика использовалась для генерации одномерного статистического отчета, содержащего информацию о центральной тенденции и изменчивости входных данных. В набор рассчитываемых этим способом параметров включены: математическое ожидание, стандартная ошибка, эксцесс, асимметрия, минимальное значение ряда данных, максимальное значение ряда данных.
Для оценки вариационных рядов количественных показателей рассчитывалось среднее арифметическое наблюдаемой переменной (М), стандартная ошибка среднего арифметического (т), среднее квадратическое отклонение (8). В таблицах и рисунках значения по группам представлены как среднее ± стандартная ошибка среднего (М ± т).
Парный двухвыборочный t-тест Стьюдента использовался для проверки гипотезы о различии средних для двух выборок данных. В нем не предполагается равенство дисперсий генеральных совокупностей, из которых выбраны данные. Парный тест используется, когда имеется естественная парность наблюдений в выборках, например, когда генеральная совокупность тестируется дважды [18]. Одним из результатов теста являлась совокупная дисперсия.
Для анализа качественных признаков использовался двусторонний точный критерий Фишера. Он был предпочтительнее, так как величина выборки в нашем случае не очень большая. Лишь при большом количестве объектов исследования (несколько тысяч) его расчеты теряют точность [67].
Для всех видов анализа проводилась оценка репрезентативности полученных результатов. При проверке статистических гипотез значимыми считались значения р от 0,05 до 0,001 [86].
Корреляционный анализ заключался в определении степени вероятностной связи между двумя и более случайными величинами. Такой анализ позволил отобрать факторы, оказывающие наиболее существенное влияние на результирующий признак, обнаружить заранее неизвестные связи между переменными. Использовался для количественной оценки взаимосвязи двух наборов данных, представленных в безразмерном виде. Коэффициент корреляции выборки представляет собой ковариацию двух наборов данных, деленную на произведение их стандартных отклонений.
Корреляционный анализ дал возможность установить, ассоциированы ли наборы данных по величине, то есть, большие значения из одного набора данных связаны с большими значениями другого набора (положительная корреляция), или, наоборот, малые значения одного набора связаны с большими значениями другого (отрицательная корреляция), или данные двух диапазонов никак не связаны (корреляция близка к нулю). Следует помнить, что наличие корреляции является необходимым, но не достаточным условием наличия причинных связей [21, 86].
Регрессионный анализ связывает зависимую переменную и внешние, предсказывающие переменные и использовался для анализа воздействия на отдельную зависимую переменную значений одной или более независимых переменных. Функция регрессии может лишь формально установить соответствие между переменными этих двух групп. Перед применением этого метода следует установить, какая переменная является главной, а какие объясняющими. Линейный регрессионный анализ заключался в подборе графика для набора наблюдений с помощью метода наименьших квадратов. Регрессия пропорционально распределяла меру качества по всем исследуемым параметрам на основе данных функционирования системы в целом. Результаты регрессии впоследствии могут быть использованы для предсказания качеств нового, непроверенного фактора [18, 67].
Уравнение для прямой линии имеет следующий вид: у = mx + b или у = mlxl + m2x2 + ... + b (в случае нескольких интервалов значений х), где зависимое значение у являлось функцией независимого значения х. Значения m - это коэффициенты, соответствующие каждой независимой переменной х, a b - это постоянная. Заметим, что у, х и m могут быть векторами [18].
Дисперсионный анализ использовался для проверки гипотезы о сходстве средних значений двух или более выборок, принадлежащих одной и той же генеральной совокупности. Этот метод распространялся также на тесты для двух средних.
Для определения прогностических критериев развития ДН у детей с СД 1 типа, нами проводился анализ 24 показателей анамнеза жизни, заболевания и течения диабета с применением методов ANOVA (однофакторный параметрический дисперсионный анализ) и MANOVA (многофакторный параметрический дисперсионный анализ).
Проведению параметрического дисперсионного . анализа предшествовала проверка гипотез о виде распределения признака. Указанное исследование входит в собственно процедуру дисперсионного анализа в качестве его первого этапа [67].


















![Функциональное состояние вегетативной нервной системы у детей и подростков с сахарным диабетом 1-го типа [Электронный ресурс] Власова Марина Станиславовна Функциональное состояние вегетативной нервной системы у детей и подростков с сахарным диабетом 1-го типа [Электронный ресурс]](/i/i/4394/186963.png)




