Содержание к диссертации
Введение
Глава 1. Обзор литературы
1.1 Анализ пероральных ЛФ противокашлевого и отхаркивающего действия природного происхождения 9
1.2 Химический состав и фармакологическая активность алтея лекарственного, солодки голой и термопсиса ланцетовидного 15
1.3 Сиропы как лекарственная форма: классификация, особенности технологии 24
1.4 Капсулы как современная перспективная лекарственная форма .30
Выводы по главе 1 .36
Глава 2. Материалы и методы исследования
2.1. Материалы исследования
2.1.1. Лекарственные вещества 37
2.1.2. Вспомогательные вещества 37
2.2. Методы исследования
2.2.1. Методы качественного и количественного определения действующих веществ алтея лекарственного, солодки голой и термопсиса ланцетовидного .39
2.2.2. Методы определения физико-химических и технологических свойств сухих экстрактов и вспомогательных веществ
2.3. Оценка качества сиропа и капсул .42
2.4. Методы фармакологических исследований
2.4.1. Определение токсичности и аллергенности сиропа 44
2.4.2. Изучение противокашлевой, муколитической и бронхолитической активности сиропа 2.5. Методы изучения стабильности сиропа и капсул 50
2.6. Статистические методы анализа 50
Выводы по главе 2 51
Глава 3. Разработка состава, технологии и исследование сиропа термоксол 52
3.1. Выбор оптимальной концентрации экстрактов в сиропе 53
3.2. Обоснования выбора основы сиропа 53
3.3. Разработка технологии получение сиропа Термоксол 54
3.4. Стандартизация сиропа
3.4.1 Разработка методик определения подлинности БАВ в сиропе 58
3.4.2 Разработка методик количественного определения БАВ в сиропе 3.5. Изучение стабильности сиропа Термоксол .70
3.6. Фармакологические исследования сиропа Термоксол 72
Выводы по главе 3 .83
Глава 4. Разработка состава, технологии и исследование капсул термоксол 84
4.1. Исследование технологических и физико-химических свойств алтея лекарственного, солодки голой и термопсиса ланцетовидного экстрактов сухих 85
4.2 . Разработка состава и технологии получения капсул Термоксол .88
4.3. Стандартизация капсул Термоксол
4.3.1. Разработка методик определения подлинности БАВ в капсулах .91
4.3.2. Разработка методик количественного определения БАВ в капсулах...93
4.4. Изучение стабильности капсул Термоксол 104
Выводы по главе 4 106
Заключение .107
Список сокращений .108
Список литературы
- Сиропы как лекарственная форма: классификация, особенности технологии
- Методы качественного и количественного определения действующих веществ алтея лекарственного, солодки голой и термопсиса ланцетовидного
- Разработка технологии получение сиропа Термоксол
- . Разработка состава и технологии получения капсул Термоксол
Сиропы как лекарственная форма: классификация, особенности технологии
Кашель – симптом, сопровождающий большинство заболеваний органов дыхания. С точки зрения физиологии, представляет собой сложнорефлекторную защитную реакцию, направленную на удаление из дыхательных путей избыточной слизи и инородных тел. По своему характеру кашель бывает сухой (непродуктивный) и влажный (продуктивный). По продолжительности делится на острый (до 3-х недель), затяжной (от 3-х недель до 3-х месяцев) и хронический (более 3-х месяцев). Учитывая то, что кашель является именно защитной реакцией при различных заболеваниях, основной задачей терапии является не устранение, а облегчение его течения. Устранение (подавление) осуществляют в случае сухого мучительного кашля.
Лечение кашля заключается, главным образом, в устранении его причин. Продуктивный кашель подавляется лишь в тех случаях, когда он изнуряет больного или мешает сну. Именно в таких случаях назначают противокашлевые средства природного происхождения. Препараты, относящиеся к этой группе, должны соответствовать ряду требований. Кроме специфического противокашлевого и отхаркивающего действия, они не должны угнетать дыхание, оказывать сильное снотворное или седативное действие, не должны вызывать привыкания, уменьшать эффект при длительном применении, повышать артериальное давление, не раздражать желудочно-кишечный тракт, должны обладать большой терапевтической эффективностью[60].
В терапии влажного кашля используют отхаркивающие и муколитические средства[8, 63, 127]. По данным разных источников, более 50% детей в возрасте до года, а также более 30% детей дошкольного и школьного возраста страдают различными заболеваниями, сопровождающимися кашлем. Сложность подбора оптимального препарата заключается в широком ассортименте противокашлевых средств, представленных на рынке, и особенностях их воздействия на физиологические процессы в организме[28, 43, 114]. Традиционно противокашлевые лекарственные препараты делятся на средства, подавляющие сухой кашель, и средства, устраняющие влажный (продуктивный) кашель. Первые угнетают кашлевой рефлекс за счет снижения чувствительности рецепторов эфферентных окончаний блуждающего нерва, расположенных в органах дыхания, или за счет угнетения кашлевого центра в продолговатом мозге. К данной группе средств относятся препараты центрального (наркотические и ненаркотические противокашлевые средства) и периферического действия[52, 71, 133]. Отхаркивающие средства (экспекторанты) способствуют выведению избыточной мокроты и восстановлению проходимости дыхательных путей. По механизму действия эта группа препаратов делится на 2 подгруппы: препараты, стимулирующие отхаркивание (секретомоторные) препараты и муколитические препараты (секретолитики).
Секретомоторные препараты усиливают перистальтику бронхиол, способствуют продвижению мокроты из нижних отделов дыхательной системы в верхние и ее выведению, а также снижают ее вязкость путем некоторого усиления секреции. По действию препараты этой группы можно разделить на рефлекторные и резорбтивные. Препараты резорбтивного действия, всасываясь в желудочно-кишечном тракте, затем выделяются слизистой оболочкой дыхательных путей, стимулируя бронхиальные железы и вызывая непосредственное разжижение мокроты[86, 131].
Препараты рефлекторного действия, в основном препараты лекарственных растений, оказывают умеренное раздражающее действие на рецепторы слизистой желудка, вследствие чего возбуждается рвотный центр в продолговатом мозге и, как следствие, усиливается секреция слюнных желез и слизистых желез бронхов.
Секретолитические препараты разжижают мокроту за счет расщепления входящих в нее полимеров (муцинов), что приводит к снижению ее вязкости и облегчению эвакуации из дыхательных путей. Муколитики показаны при клинических состояниях, сопровождающихся кашлем с густой, вязкой, трудноотделяемой мокротой[56, 67].
Согласно государственному реестру лекарственных средств Российской Федерации на февраль 2012 года зарегистрировано 43 международных непатентованных или химических наименования средств, обладающих отхаркивающим или муколитическим действием, как в монокомпонентных формах лекарственных препаратах, так и в комбинациях[55].
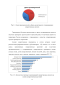
По составу препараты могут быть растительного происхождения и полученные синтетическим путем.Препараты растительного происхождения представлены большим количеством наименований, что связано с большой номенклатурой лекарственных растений, используемых в качестве отхаркивающих средств. Если говорить о странах производителях (рис. 1.1), то ощутимо большую долю занимают импортные лекарственные средства. 29 стран предлагают 80 торговых наименований лекарственных препаратов. Отечественные производители представлены 46 наименованиями лекарственных препаратов[90].
Методы качественного и количественного определения действующих веществ алтея лекарственного, солодки голой и термопсиса ланцетовидного
На основании этого, в данном исследовании для оценки анафилактогенной активности препарата морским свинкам массой тела 400 грамм вводили 6,5 мг субстанции в 0,24 мл растворителях, что соответствует дозе 16,2 мг/кг: вода (животные III-й группы) и настой шиповника (животные IV-й группы). Сенсибилизацию проводили согласно схеме: 1-ая инъекция – подкожно, 2-ая и последующие – внутримышечно, через день в область бедра. На 14-21 день после начала сенсибилизации опытным животным внутривенно вводили разрешающую дозу препарата, равную суммарной сенсибилизирующей, а контрольным – 0,9% раствор NaCl. Конъюнктивальная проба: перорально вводили 0,1 мл сиропа /свинку (2 капли), а в глаз – 1 каплю водного раствора субстанции. Ежедневно в течение 15-и суток перорально вводили по 2 капли сиропа Термоксол. Контрольные животные получали настой шиповника в том же объеме и в этот же период времени. На 16-е сутки морским свинкам опытной группы под верхнее веко вводили субстанцию Термоксола на отваре шиповника, второй глаз служил контролем, в который закапывали изотонический раствор NaCl.
При проведении реакции ГЗТ во всех опытных группах вводили дозу, эквивалентную 10 мМ раствора ПАФ в соотношении 1:1. Сенсибилизировали однократно, путем внутрикожного введения в основание хвоста в объеме 60 мкл эмульсии исследуемой субстанции препарата.
Для исследования потенциальных эмбриотоксических и тератогенных свойствсиропа Термоксол, виргинных самок крыс с нормальным эстральным циклом на стадии проэструс-эструс подсаживали на ночь к самцам в соотношении 2:1. Первый день беременности определяли по наличию сперматозоидов в вагинальном мазке утром следующего дня. Сироп Термоксол вводили в желудок каждой самке один раз в день (утром) с 1 по 19-й день беременности. День первого введения животным называется – 1-й день введения, последний день введения препарата – 19-й день введения. Контрольные животные были интактные.
В течение беременности еженедельно учитывали прирост массы тела беременных крыс. Оценку состояния потомства в конце антенатального периода проводили на 20-й день беременности. Определяли пред- и постимплантационную гибель, проводили внешний осмотр плодов, измеряли их размер и массу тела, оценивали состояние их внутренних органов и костной системы. Состояние потомства в постнатальном периоде жизни исследовали с 1 до 21-го дня жизни, учитывали прирост массы тела и выживаемость. Оценивали скорость созревания сенсорно-двигательных рефлексов в период вскармливания. Для изучения влияния на генеративную функцию крыс сироп Термоксол вводили в желудок самкам в течение 15 дней, а самцам – в течение 60 дней. После завершения периода введения подопытных животных спаривали с интактными самцами и самками. В качестве контрольных животных служили интактные самки и самцы, скрещенные между собой. Для скрещивания самок подсаживали к самцам в соотношении 2:1 сроком на 2 эстральных цикла. Оплодотворение регистрировали с помощью вагинальных мазков. Рассчитывали индекс плодовитости и индекс беременности. Полученных беременных самок делили на две группы: проводили эвтаназию самок одной группы на 20-й день беременности, подсчитывали количество желтых тел, мест имплантаций, резорбций, живых и мертвых плодов, рассчитывали пред- и постимплантационную гибель; плоды подвергали внешнему осмотру; самок другой группы оставляли для рождения и вскармливания потомства (до 21-го дня жизни), у которого учитывали динамику изменения массы тела и гибели до окончания срока вскармливания, определяли скорость созревания сенсорно-двигательных рефлексов, проводили изучение функционального состояния центральной нервной системы по ориентировочным реакциям в тесте «открытое поле».
В основе выбора доз для данного эксперимента лежала рекомендуемая суточная терапевтическая доза – 0,64 мл/кг и дозы, которые использовали при изучении общетоксического действия сиропа Термоксол.
На основании этого, в данном исследовании для оценки репродуктивной токсичности препарата крысам вводили 2 дозы: 3,0 мл/кг и 9,0 мл/кг (5- и 15-кратные суточные терапевтические).
Изучение противокашлевой, муколитическойи бронхолитической активности сиропа. Изучение противокашлевой активности Изучение противокашлевого действия сиропа Термоксол проведено на белых нелинейных мышах массой 19-20г. Использован несколько модифицированный метод Ucelay et Saha [144]. Животных размещали в прозрачном боксе из плексигласа, в котором под давлением специальной распылительной установкой и подавали кашель-индуцирующий агент -аэрозоль 25% водного раствора лимонной кислоты. Препарат вводили внутрь за 30-40 минут в дозах 0,05 и 0,1 мл/10г до аэрозольного воздействия индуктором кашля. Препарат-референт(алтея сироп) вводили внутрь в дозе 0,1 мл/10г. Изучение муколитической активности
Проведено изучение муколитического (секретолитического) действия Термоксола на лягушках. В эксперименте использовали травяных лягушек [Rana Temporarea] массой тела 30-35г, которых перед опытом промывали в проточной воде, затем фиксировали на парафиновой пластине брюшком вниз. Исследуемые препараты – сироп Термоксол и препарат-референт (алтея сироп) в количестве 0,1 мл наносили на основание языка лягушки, после чего через 30 секунд, накладывали нить на кончик языка. Для регистрации движения ресничек использовали лавсановую нить размером 10 мм. По секундомеру фиксировали время, в течение которого происходило заглатывание нити. После каждого заглатывания пищевод промывали физиологическим раствором. Изучение бронхолитической активности Было проведено изучения влияния сиропа Термоксол на величину гистаминового бронхоспазма у морских свинок. Изучение бронхолитических свойств Термоксола проводили по методу «Регистрация бронхоспазма с помощью пистон-рекордера». Метод основан на графической регистрации избытка воздуха, не вошедшего в легкие животного при искусственном дыхании с постоянным объемом вдуваемого воздуха. Бронхоспазм вызывали внутривенным введением гистамина в дозе 4 мг/кг. Термоксол вводили внутрижелудочно в дозах 0,5 и 1,0 мл/кг через 18 минут после второго контрольного введения гистамина. Затем гистамин вводили на фоне сиропа Термоксол через каждые 30 минут, в течение 120 минут.
Стабильность разработанного нами сиропа Термоксол изучали на трех сериях методом хранения в естественных условиях в защищенном от света месте при комнатной температуре (не выше 25С). Параметры качества измеряли через промежутки времени, равные 6 месяцам. Показателями качества служили: внешний вид, подлинность, плотность, значение рН, количественное содержание действующих веществ, микробиологическая чистота. Контроль проводили в течение 2,5 лет.
Изучение стабильности капсул Термоксол также проводили методом естественного хранения. Параметры качества измеряли каждые 6 месяцев в течение 2,5 лет. Показателями качества служили: описание, средняя масса, распадаемость, подлинность, количественное содержание действующих веществ.
Разработка технологии получение сиропа Термоксол
Показано, что при однократном внутрижелудочном введении лабораторным животным (мыши, крысы обоего пола) Термоксол субстанция и сироп является малотоксичным веществом. Введение субстанции Термоксола в желудок мышам обоего пола до 10000 мг/кг, сиропа до 41,7 мл/кг и крысам (самцы, самки) до 12000 мг/кг и сиропа до 52 мл/кг не приводило к гибели лабораторных животных.
При однократном внутрижелудочном введении субстанции Термоксол мышам обоего пола в дозах (1000-4000 мг/кг) признаков интоксикации не наблюдали. При увеличении дозы препарата до 12000 мг/кг через 3-5 минут после введения у всех мышей наступало беспокойство, двигательное возбуждение; через 10 минут наблюдали одышку, цианоз ушных раковин и хвоста; через 15-20 минут - снижение двигательной активности. Указанные симптомы «острого» отравления сохранялись в течение 40-60 минут. В последующий период наблюдения, через 1,5-2 часа, у всех животных отмечали нормальную двигательную активность и аппетит. Гибели животных в течение всего периода наблюдения не зарегистрировано.
Аналогичную картину «острого» отравления наблюдали при однократном внутрижелудочном введении субстанции Термоксол крысам обоего пола в дозах 8000 – 10000 мг/кг.
Одно- или двукратное введение сиропа Термоксол в желудок мышам и крысам обоего пола в объемах до 1,0 – 10 мл, соответственно 1350-13500 мг/кг, не вызывало симптомов острой интоксикации и гибели животных, в связи с чем не удалось установить параметры среднесмертельных доз.
Введение субстанции Термоксол и готовой лекарственной формы в желудок животным в более высоких дозах было нецелесообразно.
Не установлено различий в показателях токсичности препарата в зависимости от вида и пола животных. Таким образом, проведенные исследования показали, что при однократном внутрижелудочном введении лабораторным животным субстанция Термоксол и сироп являются малотоксичными.
В хроническом эксперименте на крысах сироп Термоксол вводили в желудок каждому животному один раз в день (утром) на протяжении 60-ти дней. 60-дневное внутрижелудочное введение крысам самцам и самкам в дозах 1,2 и 3,6 мл/кг (соответственно 10- и 30-кратные терапевтические дозы) не влияло на основные интегральные показатели животных: внешний вид, поведение, двигательную активность, аппетит и динамику массы тела. Потребление сухого корма и воды у крыс самцов, получавших максимальную дозу препарата 3,2 мл/кг, начиная со 2-й недели, и в течение всего хронического опыта статистически значимо было снижено, по сравнению с контролем. Введение сиропа в желудок крысам самкам в дозе 3,2 мл/кг вызывало статистически значимое снижение потребления корма и воды на 8-й неделе хронического эксперимента по сравнению с контролем. На протяжении хронического эксперимента ни в одной из экспериментальных групп не отмечено гибели животных. При исследовании гематологических показателей периферической крови: количество эритроцитов, лейкоцитов, тромбоцитов, уровень гемоглобина, гематокрит, среднее содержание и концентрация гемоглобина в эритроците, средний объем эритроцитов, гемограммы у крыс самцов и самок II- III групп не имело статистически достоверных различий с контролем. В условиях хронического эксперимента сироп Термоксол нарушал функциональное состояние печени, вызывая однократное (29-й день) увеличение содержания общего белка и альбуминов у крыс самцов и самок (II- III группы). На 59-й день исследований выявлено статистически достоверное увеличение уровня триглицеридов, мочевины и общего биллирубина (II группа, самцы) по сравнению с контролем. Сироп Термоксол не нарушал функцию почек и поджелудочной железы экспериментальных животных по биохимическим показателям сыворотки крови.
Исследование функционального состояния сердечно-сосудистой системы (ЭКГ-исследования) и почек (3% водная нагрузка) крыс обоего пола не выявило кардио- и нефротоксического действия сиропа Термоксол при длительном введении в желудок экспериментальным животным.
Сироп Термоксол во всех испытанных дозах не влиял на функциональное состояние центральной нервной системы крыс самцов и самок в тестах «ориентировочных реакций» в условиях открытого поля. Определение относительной массы внутренних органов, проведенное в конце хронического эксперимента, показало, что у крыс самцов и самок, получавших внутрь сироп Термоксол в дозах 1,2 и 3,6 мл/кг не выявило статистически достоверных изменений в коэффициентах массы сердца, легких, печени, почках, надпочечниках, тимусе, семенниках, селезенке по сравнению с контролем.
Патогистологические исследования выявили стимулирующее действие сиропа Термоксол в дозе 3,6 мл/кг на лимфоидную ткань крыс самцов и самок, проявившееся признаками гиперплазии фолликулов селезенки и бронхассоциированной лимфоидной ткани в легких и брыжеечных лимфоузлах, что свидетельствует об иммуностимулирующем действии препарата. Патогистологические исследования установили незначительный раздражающий эффект препарата в дозе 3,6 мл/кг на слизистые оболочки желудочно-кишечного тракта и слабое токсическое действие на печень крыс самцов и самок
. Разработка состава и технологии получения капсул Термоксол
Подготовка пробы. Содержимое трех капсул помещают в химический стакан объемом 150 мл, прибавляют 50 мл воды очищенной, 5 мл раствора аммиака 10%, и перемешивают до растворения. Далее полученный раствор количественно переносят в делительную воронку вместимостью 500 мл, стакан ополаскивают дважды по 25 мл воды, помещая смыв в ту же воронку. В делительную воронку прибавляют 50 мл хлороформа и осторожно встряхивают в течение 2 мин. После разделения слоев хлороформную фазу отделяют в колбу. Полученное хлороформное извлечение помещают в делительную воронку и промывают дважды по 50 мл воды очищенной. После разделения слоев хлороформную фазу отделяют и фильтруют через бумажный складчатый фильтр с 3-5 г натрия сульфата безводного в круглодонную колбу со шлифом. Отгоняют растворитель на вакуумно-выпарном аппарате при температуре 70-90С.
Методика проведения анализа. Полученный остаток растворяют в 1 мл спирта этилового 96% (испытуемый раствор). На линию старта хроматографической пластинки Сорбфил ПТСХ-П-А-УФ или аналогичную наносят в точку(I) 10 мкл (0,01 мл) испытуемого раствораи в точку (II) 10 мкл стандартногообразца термопсина. Пластинку высушивают на воздухе в течение 5 мин и помещают в вертикальную хроматографическую камеру, предварительно насыщенную в течение 20 мин смесью растворителей хлороформ – спирт 96 % в соотношении 1:1. Когда фронт растворителей пройдет 8 см, пластинку вынимают, высушивают при температуре 100С в течение 5 мин, опрыскивают реактивом Драгендорфа и рассматривают при дневном свете в течение двух минут.
На хроматограмме испытуемого раствора (Рис. 4.2) при обработке реактивом Драгендорфа обнаружены четыре зоны адсорбции оранжевого и бледно-оранжевого цвета с Rf около 0,50, 0,20, 0,15 и 0,10 (алкалоиды термопсиса). Рис. 4.2 - Хроматограмма извлечения из капсул (1) и стандарта термопсина (2) в системе хлороформ – спирт 96% в соотношении 1:1.
Далее полученный раствор количественно переносят в делительную воронку вместимостью 500 мл, стакан ополаскивают дважды по 25 мл воды, помещая смыв в ту же воронку. В делительную воронку прибавляют 50 мл хлороформа и осторожно встряхивают в течение 2 мин. После разделения слоев хлороформную фазу отделяют в колбу. Водный раствор экстрагируют еще раз 50 мл хлороформа, который после разделения слоев помещают в ту же колбу. Полученное хлороформное извлечение помещают в делительную воронку и промывают дважды по 50 мл воды очищенной. После разделения слоев хлороформную фазу отделяют и фильтруют через бумажный складчатый фильтр с 3-5 г натрия сульфата безводного в круглодонную колбу со шлифом. Водный раствор экстрагируют еще раз 50 мл хлороформа. Полученное хлороформное извлечение фильтруют через фильтр в ту же колбу. Отгоняют растворитель на вакуумно-выпарном аппарате при температуре 70-80С. Остаток растворяют в 30 мл 70% спирта. Полученный раствор помещают в делительную воронку. Колбу поласкивают еще 20 мл спирта 70%, который помещают в ту же воронку. В делительную воронку прибавляют 50 мл петролейного эфира (70-100С) и встряхивают в течение 2 мин. После разделения слоев эфирное извлечение отбрасывают. В делительную воронку помещают водно-спиртовое извлечение, прибавляют 5 мл раствора аммиака 10%, 50 мл хлороформа и встряхивают в течение 2 мин. После разделения слоев хлороформный слой сливают в колбу, а из водного раствора повторяют извлечение еще раз 50 мл хлороформа.
Объединенные хлороформные извлечения фильтруют через бумажный складчатый фильтр с 3-5 г натрия сернокислого безводного в круглодонную колбу вместимостью 500 мл. Фильтр промывают 10 мл хлороформа, который присоединяют к основному раствору. Полученное хлороформное извлечение упаривают досуха на вакуумно-роторном испарителе на кипящей водяной бане (раствор А). Остаток растворяют в 24 мл спирта этилового 70% и количественно переносят в мерную колбу вместимостью 25 мл, доводят до метки спиртом этиловым 70% и перемешивают (испытуемый раствор). Оптимизация условий определения была сопряжена с трудностями отделения суммы алкалоидов от сопутствующих веществ, для этого предусмотрели экстракция в несколько ступеней.
В качестве аналитической длины волны выбрана таковая в максимуме поглощения (308 нм) (Рис.4.3).
Спектр извлечения из капсул (2) и раствора термопсина в этиловом спирте (1) В экстракте термопсиса сухом согласно требованиям, должно содержаться от 0,95% до 1,05% суммы алкалоидов в пересчете на термопсин. Таким образом, в одной капсуле 0,25 г, содержащей около 0,01 г экстракта должно содержаться не более 0,000105 г алкалоидов или не более 0,042%.
Определение коэффициента удельного поглощения проводили на образце термопсина (Sigma S449083-1EA). Измеряли оптическую плотность испытуемого раствора при длине волны 308±1 нм в кювете с толщиной слоя 10 мм; в качестве раствора сравнения используют 70% спирт этиловый.
Методика прецизионна и характеризуется сходимостью (повторяемостью), т.е. проведение анализа в одинаковых условиях обеспечивает получение сравнимых результатов. Результаты определения показателя на разных приборах в разные дни показало, что методика отвечает требованиям промежуточной (внутрилабораторной) прецизионности (табл. 4.5)