Содержание к диссертации
Введение
Глава I Обзор литературы 8
1.1 Эпидемиология МБ .8
1.2 Клиническая картина МБ .9
1.3 Диагностика МБ 9
1.4 Патоморфология МБ .14
1.5 Основные иммуногистохимические маркеры МБ 17
1.6 Молекулярные и генетические нарушения МБ 17
1.7 МБ при наследственных синдромах 21
1.8 Стадирование и стратификация по группам риска .22
1.9 Лечение МБ у детей старше трех лет .24
1.10 Рецидивы МБ .41
Глава II Характеристика пациентов, методы исследования и лечения
Статистическая обработка данных .54
Глава III Результаты собственных исследований .55
3.1 Токсичность ВДХТ с трансплантацией аутологичных ПСКК .55
3.2 Восстановление кроветворения 63
3.3 Эффективность проведенного лечения 65
Глава IV Результаты лечения МБ у детей старше трех лет 71
Заключение .84
Выводы 88
Приложения 89
Список литературы
- Клиническая картина МБ
- Патоморфология МБ
- Молекулярные и генетические нарушения МБ
- Восстановление кроветворения
Клиническая картина МБ
Заболеваемость опухолями головного возраста в детском возрасте составляет 3,6 на 100000 детского населения в год. МБ является наиболее распространенной опухолью головного мозга у детей и составляет примерно 20% всех опухолей ЦНС, и 40% опухолей задней черепной ямки. Частота заболеваемости у детей от рождения до 19 лет составляет 0,6 на 100000 населения по данным Реестра опухолей ЦНС США в 2008 году. [68] Пик заболеваемости приходится на возраст от 5 до 7 лет (8 случаев на 1000000 детского населения в год). [25]
Примерно 30% всех МБ диагностируется у детей старше 10 лет. МБ чаще всего локализуется по срединной линии и поражает мозжечок. Мальчики болеют чаще, чем девочки в 1,6 раза. У взрослых МБ встречается крайне редко – примерно в 1% всех опухолей ЦНС. [11, 25]
Этиология МБ, в настоящее время, до конца не известна. Тем не менее небольшая доля МБ встречается у детей с наследственными синдромами, такими как синдром Горлина, синдром Туркота [79], синдром Ли – Фраумени, синдром атаксии телеангиэктазии. [36] 1.2 Клиническая картина МБ
Клинические проявления МБ могут быть различными и зависят от возраста пациента, распространенности и локализации заболевания. Основные клинические симптомы МБ развиваются вследствие повышения внутричерепного давления из – за обструктивной гидроцефалии, к ним относятся: повышенная раздражительность, рвота, увеличение окружности головы (у младенцев), головные боли, диплопия, нистагм, атаксия, отек диска зрительного нерва. Наиболее частым симптомом у детей старшего возраста являются головные боли. При поражении червя мозжечка появляются туловищная атаксия и неустойчивость походки, тогда как при поражении гемисфер мозжечка могут быть аппендикулярная атаксия и дисметрия. Диссеминированные формы могут проявляться различными симптомами в зависимости от области поражения: судороги, нарушение функции органов малого таза и др.
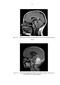
Также могут присутствовать симптомы поражения черепных нервов, особенно III, IV и VI пар. Диагностика МБ. К основным методам диагностики МБ можно отнести магнитно – резонансную томографию (МРТ) и рентгеновскую компьютерную томографию (РКТ). РКТ иногда является первым инструментальным исследованием у детей с подозрением на МБ. Характерной для МБ картиной при РКТ исследовании является наличие гомогенного, накапливающего контрастное вещество (КВ) образования, чаще всего локализованного по центральной линии. Тем не менее, МРТ является более предпочтительным методом диагностики МБ до хирургического вмешательства. МРТ признаки, наиболее характерные для МБ, включают в себя наличие гипоинтенсивного гетерогенного образования в Т1 режиме (Рис. 1). Накопление КВ, чаще всего гетерогенное (Рис. 2). Наиболее частая локализация МБ это червь мозжечка, который поражается в 93% случаев МБ. Вовлечение в процесс ствола головного мозга встречается в 32% случаев. [62] Поражение спинного мозга, которое встречается, по данным разных авторов от 30% до 40% случаев, чаще всего локализуется в пояснично – крестцовой и грудной области. [8, 41] Учитывая, что наличие метастатического поражения спинного мозга является плохим прогностическим фактором при МБ, ранная диагностика поражения спинного мозга является очень важным условием. [52] Лучшей методикой, для диагностики метастазов МБ, является МРТ спинного мозга с контрастированием. [78] Ложно – положительные результаты МРТ могут быть в течение двух недель после операции, из – за появления метгемоглобина, поэтому диагностику метастатического поражения спинного мозга лучше проводить не менее чем через 14 дней поле хирурического вмешательства. [52] На рисунке 3 приведен пример типичного метастатического поражения спинного мозга у ребенка с МБ (Рис. 3). Также в диагностике лептоменингеального распространения МБ используется цитологическое исследование ликвора. [84] МРТ головного и спиного мозга должна быть основным методом обследования на всех этапах лечения МБ. Метастазирование МБ вне ЦНС встречается достаточно редко (7%) и является крайне неблагоприятным фактором. Наиболее чаcтым местом метастазирования МБ вне ЦНС, являются кости и костный мозг. [70]
Патоморфология МБ
Лептоменингеальное распространение в этой группе определяется редко. В настоящее время выживаемость у детей из данной группы составляет около 95%. [24, 27] SHH группа МБ представляет собой группу МБ промежуточного риска с показателем выживаемости от 60 до 80%. [44, 57, 58] Встречается примерно в 35% случаев МБ у детй. Основная гистологичсекая форма МБ в этой группе десмопластическая, также встречается классическая и анапластическая/крупноклеточная формы, но крайне редко. [23] К основным генетическим изменения в МБ SHH группы относятся мутации генов PTCH1 и MYCN. [44, 57, 58] При генетическом анализе в SHH группе определяется бльшее количество хромосомных аномалий, по сравнению с WNT группой. Например делеции 9q и 10q и множество других. [30, 44]
Group 3 МБ в настоящее время является группой с наихудшим прогнозом, выживаемость пациентов в данной группе составляет не более 50%. Частота встречаемости данной группы приблизительно 25%. Чаще встречается у мальчиков. Основной патоморфологический тип анапластическая/крупноклеточная МБ. Более 40% больных имеют метастатическое поражение спинного мозга при первичной диагностике. [44, 53, 57] Практически во всех случаях МБ group 3 определяется амлификация гена MYC и практических всегда выявляется выраженная его экспрессия. В данной группе МБ также иммется большое количество хромосомных нарушений, таких как делеция 10q, 11 и 16q, 17p. Аберрации, связанные с 17 хромосомой чаще всего представлены изохромосомой 17. [30, 44]
Наиболее распространенной группой является Group 4, которая встречается примерно в 35 – 40% случаев МБ. Пациенты с данной группой МБ имеют средний риск. Мальчики болеют в 3 раза чаще. Основной патоморфологический тип – классическая МБ, но также может встречаться и крупноклеточная/анапластическая. Метастатическое поражение встречается примерно у трети пациентов. Протоонкогены MYCN и циклин зависимая киназа 6 определяется довольно часто. В большинстве случаев определяется изохромосома 17. Уровень выживаемости детей с данным типом МБ не превышает 75% [53, 57]
Медуллобластома при наследственных синдромах МБ может возникать при определенных наследственных синдромах, таких как синдром Горлина, синдром Туркота и синдром Ли – Фраумени.
Синдром Туркота диагностируется у пациентов с первичными опухолями головного мозга и колоректальным раком. Разделяется на два типа. МБ возникает чаще при втором типе синдрома Туркота. Генетическое нарушение при втором типе синдрома Туркота – это генеративная мутация в гене APC, который является онкосупрессором и регулирует уровень – катенина – активатора пути патогенеза МБ WNT. [10] У детей с аденоматозным полипозом вероятность развития МБ в 95 раз выше, по сравнению с основной популяцией. [22, 24]
Синдром Горлина – аутосомно доминантное заболевание, характеризующееся множественным аномалиями развития (При синдроме Горлина возникают такие опухоли как базальноклеточный рак кожи, опухоли яичников и МБ. [10] Вероятность развития МБ при данном синдроме приблизительно 4%, причем наиболее частый вариант МБ – десмопластический. Это объясняется тем, что синдром Горлина развивается в следствие мутации гена PTCH, который принимает участие в SHH пути патогенеза МБ. [10, 22] Синдром Ли – Фраумени встречается крайне редко и ассоциируется со многими злокачественными новообразованиями, преимущественно связан с мутацией гена TP53. Известно, что в 70% случаев при синдроме Ли – Фраумени имеется мутация гена TP53. [38] Мутация гена TP53 при МБ описана примерно в 10% случаев, причем наличие изменений в гене TP 53, ассоциируется с анапластическим типом МБ. [12]
Стадирование и стратификация по группам риска Стадирование и определение группы риска является ключевым моментом в лечении МБ. Основными критериями стратификации по группам риска являются исследование ликвора и МРТ головного и спинного мозга с внутривенным контрастированем. Традиционно пациенты с МБ разделяются на две группы риска: группа среднего риска и группа высокого риска, соответственно результатам цитологического исследования спинномозговой жидкости (СМЖ) и наличию остаточной опухоли.
Молекулярные и генетические нарушения МБ
Всем больным на “нулевые” сутки режима ВДХТ проводилась трансфузия аутологичных ПСКК. На день +1, с целью стимуляции костного мозга, назначался гранулоцитарный колониестимулирующий фактор (ГКСФ) (Граноцит, Лейкостим, Теваграстим) в дозе 5 мкг/кг однократно в сутки. ГКСФ вводились до дня достижения абсолютного количества нейтрофилов до 2 109/л и два последующих дня. Начиная со дня +1 велся ежедневный мониторинг показателей периферической крови. Днем восстановления считался день, когда уровень лейкоцитов (WBC) достигал 0,5 109/л. Количество переливаемых стволовых (CD34+) клеток составило от 0,2 106/кг на курс до 2,8 106/ на курс, в среднем количество CD 34+ клеток составило 1,27 106/кг на курс. Длительность аплазии варьировала от 8 до 29 дней, в среднем 12 суток от дня трансфузии аутоПСКК.
В нашем исследовании выявлена стойкая зависимость длительности аплазии от количества переливаемых CD34+ клеток. При количестве CD 34+ менее 1 106/кг длительность аплазии была более 10 суток, что увеличивало риск развития тяжелых инфекционных осложнений. (Таблица 11) Таблица 11
Таким образом, можно сделать вывод, что предпочтительное количество CD 34+ клеток для обеспечения относительно быстрого восстановления костного мозга – 1 106/кг и более. (p = 0,003) Особого внимания заслуживает гемотрансфузионная поддержка пациентов, получивших ВДХТ. 100% пациентов требовали трансфузии препаратов крови (тромбоконцентрат, эритроцитарная масса). В среднем на курс производилось 2 – 3 трансфузии тромбоконцентрата и 1 – 2 трансфузии эритроцитарной массы. 3.3 Эффективность проведенного лечения
Оценка эффективности программы терапии проводилась через месяц после окончания Оценить эффективность курса ЛТ было возможно у 14 больных с измеряемой остаточной опухолью и метастазами по оболочкам спинного мозга (М3). У остальных 16 больных признаков остаточной опухоли и поражения оболочек спинного мозга, до начала курса лучевой терапии, выявлено не было. И у одного пациента при отсутствии признаков остаточной опухоли, были обнаружены опухолевые клетки в ликворе.
На рис. 16 приведен пример выраженной положительной динамики у ребенка с диссеминированной МБ после окончания курса ЛТ. Рис. 16: Т1 – взвешенные изображения после МРТ после внутривенного контрастирования показывающие выраженный положительный ответ на проведение ЛТ у девочки с диссеминированной МБ: А – до начала курса ЛТ, В – контрольное МРТ перед началом ПХТ. (стрелочкой отмечено поражение оболочек спинного мозга до ЛТ)
При оценке результатов МРТ головного и спинного мозга достижение полного ответа (отсутствие достоверных очагов патологического накопления контрастного вещества) было получено у 6 из 15 пациентов, что составило 40% от общего числа больных с измеряемой остаточной опухолью и наличием метастазов по спинному мозгу, а частичный ответ, в виде уменьшения размеров остаточной опухоли и метастазов в оболочки спинного мозга был получен у 9 из 15 пациентов (60%) (Таб. 12).
Нужно отметить, что у троих пациентов, у которых были признаки остаточной опухоли после окончания всего курса терапии, при дальнейшем наблюдении был диагностирован рецидив. У одного пациента диссеминированный рецидив через 18 месяцев после окончания лечения (пациент погиб от прогрессирования болезни). У двух оставшихся локальные рецидивы в ложе опухоли через 2 и 3,5 года после окончания лечения (получили противорецидивную терапию, в настоящее время под наблюдением без признаков повторного рецидива). У 15 пациентов, после проведения хирургического лечения признаков остаточной опухоли и метастатического поражения не было отмечено. Из них 14 детей были включены в группу среднего риска (13 с классической МБ и 1 с десмопластической МБ) и 1 ребенок с анапластической/крупноклеточной МБ был включен в группу высокого риска. Во время нахождения на этапах ЛТ и ВДХТ ни у одного из этих пациентов не было зарегистрировано прогрессирования заболевания.
В ходе динамического наблюдения было зарегистрировано 8 рецидивов, что составило 26,7% из всех наблюдаемых случаев. Из них ранний рецидив, в течение 6 месяцев от окончания лечения, был зарегистрирован у двух пациентов (25%), остальные рецидивы были зарегистрированы более чем через 1 год более окончания лечения. По характеру рецидивирования 50 % рецидивов составили диссеминированные, остальные 50 % локализованные в ложе первичной опухоли.
На рисунке 17 представлены МРТ изображения диссеминированного рецидива МБ у ребенка 10 лет, через 18 месяцев после окончания программы терапии с достижением частичного ответа (уменьшение размеров остаточной опухоли 50%).
На момент написания работы из всех 30 пациентов, включенных в исследование живы без признаков рецидивирования заболевания 20 пациентов, что составляет 66,7%. Средний период наблюдения составил 57,9±4,0 месяцев (от 5 до 68 мес.). Из оставшихся 10 пациентов у 8 развился рецидив заболевания в сроки от 5 месяцев от окончания лечения до 3,5 лет. Локализованные и диссеминированные рецидивы составили по 50%. Из этих 8 пациентов с рецидивами живы 6 человек. Двое пациентов (6,7%) погибли от инфекционных осложнений IV степени, сепсиса.
Хорошо известно, что на выживаемость детей с медуллобластомой влияют многие факторы, такие как наличие или отсутствие метастатического поражения спинного мозга, радикальность проведенного хирургического лечения, гистологический вариант опухоли. В нашей работе проводился расчет выживаемости в общей группе, по группам риска, по наличию М+ стадии и по наличию остаточной опухоли.
Восстановление кроветворения
Медуллобластома – одна из самых частых злокачественных опухолей головного мозга в детском возрасте и составляют около 20% от всех опухолей ЦНС. [25]
За последние 20 лет выживаемость детей старше трех лет с МБ среднего риска значительно улучшилась и достигла 75 – 80% благодаря использованию режимов интенсивно ПХТ, проведением агрессивной ЛТ в объеме КСО и включению в программы лечения ВДХТ с трансплантацией аутологичных ПСКК или КМ. Тем не менее, в группе с неблагоприятным прогнозом, в которую включаются пациенты с большой остаточной опухолью, наличием метастатического поражения в пределах ЦНС, а также пациенты с анапластической/крупноклеточной МБ до сих пор показывают худшую выживаемость, которая не превышает 50%.
Целью нашего исследования было показать, что применение 4 курсов ПХТ с использованием высокодозного циклофосфана, после проведения ЛТ в объеме КСО в дозе 36 Гр с локальным облучением ЗЧЯ до 54 Гр, у детей с неблагоприятными факторами прогноза, позволит улучшить показатели выживаемости в данной группе.
В исследование было включено 30 детей с гистологически подтвержденной МБ в возрасте от 3 до 18 лет.
Несмотря на высокую интенсивность и потенциальную токсичность предлагаемого режима ПХТ, гематологическую токсичность IV степени в 100% случаев, смертность на протоколе, составила 6,7%, что сопоставимо с аналогичными зарубежными программами. Инфекционные осложнения, возникающие на фоне аплазии костного мозга IV степени, контролировались своевременным назначением антибактериальной терапии, проведением бактериологических исследований, с целью идентификации возбудителя и коррекции антибактериальной терапии. Органная токсичность на фоне проводимой ВДХТ также не лимитировала проведение терапии. Следует отметить, что проведение ЛТ, также сопровождалось побочными явлениями, которые, тем не менее, не являлись причиной прерывания или отмены ЛТ.
Несмотря на то, что развивающиеся осложнения не являются лимитирующими, проведение лечения по предложенной нами программе должно проводиться в многопрофильных федеральных центрах с хорошо развитой интенсивной терапией, нейрохирургией, реанимацией, имеющих хорошую лабораторно – диагностическую базу.
Таким образом, проведя анализ 5 – летней БРВ и ОВ в нашем исследовании, можно сделать вывод, что предлагаемая нами программа лечения детей старше трех лет с МБ, показывает сравнимые с мировыми данными результаты. Тем не менее, в группе пациентов с наличием остаточной опухоли больших размеров и наличием метастатического поражения оболочек спинного и/или головного мозга остается низкой и требует новых принципов подхода к лечению пациентов из неблагоприятной группы. Дальнейшая интенсификация ВДХТ в виде увеличения дозы химиопрепаратов, таких как циклофосфан (в нашем исследовании общая средняя доза циклофсфана составила 15440 мг/м2), не представляется возможным, так как препараты такого типа приводят к снижению или полной потере фертильности.
В тоже время, учитывая результаты исследований в области молекулярно – генетических особенностей МБ у детей, можно выделить прогностически благоприятную группу больных, в которой показатели выживаемости более 80% и, может быть, не требует высоко интенсивного лечения, которое связано с риском тяжелых осложнений, как на фоне проводимой терапии, так и после его окончания.Учитывая последние мировые исследования в области биологии и молекулярно – генетических особенностей МБ, новые исследования должны быть направлены на поиски таргетных препаратов, т.к. дальнейшая интенсификация проводимой ПХТ и ВДХТ может приводить к тяжелы побочным явлениям и осложнениям, которые приводят к гибели пациентов.
Перед тем, как говорить о результатах нашего исследования, следует отметить, что группа анализируемых наблюдений, для предоставления статистически значимых результатов, мала и включает в себя 30 пациентов. Но, тем не менее, в вопросе о минимально необходимом количестве CD 34+ клеток для трансплантации, мы получили достоверные результаты (p = 0,003), которые показывают, что количество CD 34+ клеток должно быть не менее 1 106/кг на курс, что позволяет значительно снизить риск развития тяжелых инфекционных и органных осложнений, восстановление костномозгового кроветворения в сроки до 10 суток, что в свою очередь дает возможность соблюдения тайминга программы.
Итак, при проведении данной программы, мы получили следующие результаты: 5 – летняя БРВ у пациентов средней группы риска составила 78,6±11,0%, что сопоставимо с результатами различных зарубежных исследований [9, 15, 26, 37, 71], тем не менее, у пациентов группы высокого риска уровень 5 – летней БРВ составил 53,0±17,9%, что достаточно низко и требует дальнейшей оптимизации программ терапии для пациентов группы высокого риска с использованием новых данных


















![Разработка оптимальных методов криоконсервирования кроветворных клеток пуповинной крови человека для трансплантаций [Электронный ресурс] Гришина Виктория Валерьевна Разработка оптимальных методов криоконсервирования кроветворных клеток пуповинной крови человека для трансплантаций [Электронный ресурс]](/i/i/4404/192487.png)




