Содержание к диссертации
Введение
1. Литературный обзор «Взаимодействие карбонильных соединений с а,р-непредельными нитрилами».
1.1 Синтез аддуктов Михаэля.
1.2 Синтез карбоциклических соединений 23
1.3 Синтез пятичленных гетероциклов 31
1.4 Синтез пиранов 34
1.5 Синтез пиридинов 42
2. Обсуждение результатов 46
2.1 Реакции конденсации N-ацетил-индол-З-она
2.1.1 Реакции N-ацетил-индол-З -она с арилметиленмалононитрилами 47
2.1.2 Одностадийный синтез 2-амино-4-арил-5-ацетил-3-цианопирано[3,2-6]индолов 48
2.2 Реакции конденсации 6-метокси-2Ябензо[Ь]фуран-3-она 63
2.2.1. Реакции 6-метокси-2Я-бензо[6]фуран-3-она с арилметиленмалононитрилами
2.2.2. Одностадийный синтез 2-амино-З-цианодибензофуранов 64
2.3.1 Реакции 2Я-бензо[А]тиофен-3-она с арилметиленмалононитрилами 76
2.3.2 Одностадийный синтез, 2-амино-4-арил-3-циано-4Я-бензотиено[3,2]пиранов.
2.4 Реакции конденсации 4,6-диметил-2Я-тиено[2,3-6]пиридин-3-она 82
2.4.1 Реакции 4,6-диметил-2Я-тиено[2,3-6]пиридин-3-она с арилметиленмалононитрилами
2.4.2 Модификация метода синтеза замещенных 4Я-пирано[2',3'-4,5]тиено[2,3- 83 Ь] пиридинов
2.4.3 Синтез спиросочлененных 2-амино-7,9-диметил-3-циано-4Я-пирано[2\3'- 90 4,5]тиено[2,3-^]пиридинов
2.5.1 Реакции а-тетралона с арилметиленмалононитрилами 96
2.5.2 Модификация метода синтеза нафтопиранов 97
2.6.1 Реакции а-хроманона с арилметиленмалононитрилами 106
2.6.2 Модификация метода синтеза пирано[3,2-с]хромена 107
2.7 Влияние гетероатома на направление реакции ^/^-непредельных нитрилов с монокарбонильными бензоаннелироваными соединениями
3. Экспериментальная часть 115
Выводы 121
Список литературы 122
- Синтез карбоциклических соединений
- Реакции N-ацетил-индол-З -она с арилметиленмалононитрилами
- Реакции 6-метокси-2Я-бензо[6]фуран-3-она с арилметиленмалононитрилами
- Реакции а-тетралона с арилметиленмалононитрилами
Введение к работе
Актуальность проблемы: Монокарбонильные бензоаннелированные соединения широко используются в органическом синтезе в качестве исходных реагентов. Так, взаимодействие карбонильных соединений с oj/S-непредельными нитрилами происходит с образованием карбо - и гетероциклов, труднодоступных другими методами. Возможность введения разнообразных заместителей в молекулы исходных соединений позволяет синтезировать широкий круг гетероциклов, в том числе замещенные пираны, тиопираны, пиридины, пиримидины и другие гетероциклы. Следует отметить, что в результате этих реакций образуются соединения, содержащие модифицируемые функциональные группы (вицинально расположенные циано-, карбонильные и аминогруппы) и представляющие интерес в синтезе других соединений, важных практически и играющих значительную роль в различных биологических процессах. Их биологическая активность в большой степени зависит от их строения, а именно от наличия заместителей в гетероцикле, от аннелирования его с другими циклами. На практике эти соединения применяются в качестве красителей, пестицидов, лекарств.
Непредельные соединения, активированные электроноакцепторными нитрильными заместителями, реагируют с карбонильньвди соединениями в мягких условиях, что позволяет в ряде случаев выделить промежуточные продукты, достичь высокой регио- и стереоселективности реакций и обеспечить простое аппаратурное оформление процессов. Это важное преимущество, поскольку большинство известных синтетических методов, включающих использование арилметиленмалононитрилов, являются многостадийными и не региоселективными. Кроме того, это дает нам представление о механизмах реакций, что в свою очередь позволяет создавать новые методы синтеза различных практически важных гетероциклов.
Целью диссертационной работы являются:
Всестороннее изучение селективности реакции бензоаннелированных гетероциклических карбонильных соединений"с"а;/^-непредельными нитрилами;
Разработка одностадийных методов синтеза аннелированных 2-амино-4Н-пиранов и дицианоанилинов, включая и новые гетероциклические системы;
Изучение реакций гетероциклических карбонильных соединений с кетонами (производные циклогексанона и пиперидона) и производными циануксусной кислоты;
Изучение влияния іетероатома, находящегося в положении 1 на направление реакции
о;/?-непредельных нитрилов с монокарбонильными бензоаннелированными соединениями.
Научная новизна и практическая ценность.
- В результате всестороннего изучения реакций а;/?-непредельных нитрилов с
бензоаннелированными гетероциклическими и карбоциклическими кетонами установлена
селективность этих процессов, которая прежде всего зависитр|)щрдщя»даж*ЛЯЯМда|и
З I БИБЛИОТЕКА |
\ о» Щ^шжчсН
кетонов.
Реакции 1-ацетил-1,2-дигидро-ЗЯ-индол-З-она, 2Я-бензо[6]тиофен-3-она и 4,6-диметил-2Я-тиено[2,3-6]пиридин-3-она с «^непредельными нитрилами протекают с образованием аннелированных 2-амино-4Я-пиранов.
Впервые установлено, что в отличие от указанных выше аналогичные реакции б-метокси-2Я-бензо[і]фуран-3-она протекают с образованием дицианоанилинов.
На основе этих данных разработаны новые простые селективные методы синтеза, не требующие предварительного получения и выделения «Д-непредельных нитрилов, такие как: синтез замещенных 2-амино-4Я-пирано[3,2-6]индолов путем трехкомпонентной конденсации моля кетона, моля малононитрила и моля соответствующего альдегида.
синтез замещенных 2-аминодибензофуранов путем трехкомпонентной конденсации моля кетона, двух молей малононитрила и моля соответствующего альдегида.
синтез замещенных 2-амино-4Я-бензотиено[3,2-6]пиранов на основе трехкомпонентной конденсации моля кетона, моля малононитрила и моля соответствующего альдегида.
синтез замещенных 2-амино-4Я-пирано[2\3'-4,5]тиено[2,3-6]пиридинов на основе трехкомпонентной конденсации моля кетона, моля малононитрила и моля соответствующего альдегида.
Практическую ценность представляет возможность использования полученных результатов в комбинаторной химии для создания библиотек карбо- и гетероциклов и поиска среди них биологически активных соединений.
Апробация работы. Результаты диссертационной работы были представлены на Седьмом симпозиуме по химии гетероциклов "Blue Danube" (Eger, Hungary, 1998), на Второй международной конференции молодых ученых "Актуальные тенденции в органическом синтезе на пороге новой эры" (Санкт-Петербург, Россия, 1999), на конференции "Молодежная научная школа по органической химии" (Екатеринбург, Россия, 2000) и на Третьем Всероссийском симпозиуме по органической химии "Стратегия и тактика органического синтеза" (Ярославль, Россия, 2001).
Публикации. Содержание диссертации изложено в трех статьях и четырех тезисах в сборниках докладов научных конференций.
Структура и объем работы. Материал диссертации изложен на 130 страницах, содержит 34 таблицы и 1 рисунок. Библиография включает 176 литературные ссылки на научные публикации. Диссертация включает в себя введение, литературный обзор «Взаимодействие карбонильных соединений с «/^непредельными нитрилами», обсуждение результатов диссертационной работы, экспериментальную часть, выводы и список литературы.
Синтез карбоциклических соединений
Карбоциклические соединения образуются в тех случаях, когда на стадии циклизации аддуктов в качестве нуклеофильного центра выступает атом углерода метильной, метил еновой или метиновой группы, активированной электроноакцепторными заместителями, а в качестве электрофильного центра - атом углерода карбонильной или нитрильнои группы8. Взаимодействие 1,3-дикарбонильных соединений 5а,Ь с замещенными нитрилами 87а,Ь происходит через стадию циклизации промежуточных аддуктов Михаэля 88 по ароильной группе и приводит к соединениям 89а,Ь 25,71 .
В ряде случаев промежуточные аддукты Михаэля способны присоединяться ко второй молекуле исходного непредельного нитрила, а образующийся бисаддукт может далее циклизоваться по Торпу. Так реагируют дибензоилметан 5к с 1,1-Дицианоэтиленом (93) \ и оксиндол 43 - с бензилиденмалононитрилом 38а 32. Полученные продукты 94, 95 содержат шестичленные карбоциклы .
Для ряда непредельных кетонов (7d-j) содержащих в а-положение двойную связь активного характера тетрацианоэтилирование ведет в зависимости от размера заместителей при двойной связи, к образованию двух типов соединений - 3,3,4,4-тетрацианоциклогексанонов (102a-g) и продуктов гидролиза одной нитрильной группы лактамов (103a-g),5 .
Соединения 24a-d под действием пероксида водорода в метаноле превращаются в эфиры 104a-d, которые при кипячении в присутствии метилата натрия подвергаются последующей циклизации в замещенные циклогександионы 105a-d .
Ряд работ посвящен изучению взаимодействия 2-цианометилтиазолидин ПОа-d и тиазолин-4-онов 80a-d с арилиденмалононитрилами 38а,Ь,1. При этом, имеет место присоединение по Михаэлю соединений ПОа-d и 81a-d к непредельным нитрилам 38 за счет активной метиленовой группы. Последующее замыкание пиридинового цикла ведет к образованию 4-амино-6-арил-2-арилметилен-3-оксо-5-циано-2,3-дигидро-6Я-тиазоло[3,2-д]пиридинов 111а-1 " . Логическим продолжением выше описанной реакции является новый трехкомпонентный метод синтеза тиазоло[3,2-а]пиридинов 111а-1 из альдегида 41a,b,g, малононитрила 36 и 2-цианометилтиазолин-4-она 80a-d . Промежуточным является аддукт
В результате реакции между бензальдегидами (41 a,b,g-m), малононитрилом (36) и N-метил-4-пиперидоном (114) получены соединения (115 a-d,f), которые могут быть ароматизированы в новые дициано-1,2,3,4- тетрагидроизохинолинамины (116 а-е), тетрагидро-2,7 нафтиридины (117 а,Ь) получены как побочные продукты (схема 42) АгСНО + 2CH2(CN).
Было установлено, что взаимодействие арилиденмалононитрила 38a,b,h,j,q с илидами пиридиния 121 приводит к образованию трансзамещенных циклопропанов 122а-е 91,92. Трехчленные гетероциклы могут быть синтезированы из моногалогенпроизводных метиленактивного соединения и ТЦЭ(1а). В качестве моногалогенпроизводных метиленактивного соединения может быть использован 2-бром-5,5-диметил-1,3-циклогександион (123). При взаимодействие его с ТЦЭ (1а) в водно-диоксановой среде был получен 6,6-диметил-4,8-диоксоспиро[2.5]октан-1,2,2,2-тетракарбонитрил (124) .
Реакции N-ацетил-индол-З -она с арилметиленмалононитрилами
Схему данной реакции можно представить следующим образом (схема 2). Первоначально при обработке 1-ацетил-1,2-дигидро-ЗЯ-индол-3-она (1) триэтиламином, образуется енолят-анион 4, который в дальнейшем взаимодействует с арилметиленмалононитрилом 3 по реакции Михаэля. Аддукт Михаэля 5 в основной среде претерпевает внутримолекулярную циклизацию с образованием иминопиранов 6. Таутомерное превращение последних приводит к 5-ацетил-2-амино-4-арил-3-циано-4,5-дигидропирано[3,2-6]индолам (2).
Схема 2 г Me На направление реакции влияет природа заместителя в арилметиленмалононитриле 3 . Так, например, в реакцию хорошо вступает незамещенный фенилметиленмалононитрил За, его замещенные аналоги, содержащие акцепторный заместитель - (нитро группу, атом галогена), а также гетероциклические производные пиридинового и тиофенового ряда. Арилметиленмалононитрилы 3, содержащие электродонорные заместители (одну или две алкоксигруппы, диалкиламино группы), в реакцию не вступают. Наиболее вероятно, что это связано с понижением электрофильности /?-С-атома непредельного нитрила, вызванным электронодонорными заместителями.
Пираны 2 можно получить более простым методом, в одну стадию, без предварительного синтеза арилметиленмалононитрилов 3, путем трехкомпонентной конденсации N-ацетил-индол-З-она (1), малононитрила 7 и соответствующего альдегида 8 (схема 3, Метод Б). Трехкомпонентная конденсация и ранее использовалась для синтеза замещенных 2-амино-4Я-пиранов. Конденсацией альдегидов, малононитрила и этилового эфира ацетоуксусной кислоты были получены соответствующие 2-амино-4-арил-6-метил-3-циано-5-этоксикарбонил-4Я-пираны131. 2hienyl-5-BrC6H4 (2v) 18 Некоторые соединения, в частности, аннелированный пиран, содержащий 4-пиридильный заместитель 2s, могут быть получены только этим методом, поскольку реакция малононитрила 7 и альдегида 8s приводит к образованию замещенного циклогексена 9 ш .
Вероятно, в нашем случае генерируемый 4-пиридилметиленмалононитрил 3s взаимодействует с N-ацетил-индол-З-оном (1) и образуется соответствующий пирано[3,2-6]индол 2s. Строение соединений 2 подтверждено физико-химическими методами анализа (таб. 5,6). Согласно Кембриджскому банку структурных данных, в литературе отсутствуют сведения о строении подобных 2-амино-4-арил-3-циано-4Я-пираны аннелированные с 1-ацетил-1,2-дигидро-ЗЯ-индол-З-оном (1).
По данным РСА (рис. 1) в молекуле 2q конформация замещенного 4Я-пиранового гетероцикла- сильно уплощенное кресло, атомы 0(1) и С(4) отклоняются в противоположные стороны от плоскости С(2)-С(3)-С(1А)-С(4А) (выполняется с точностью 0.011 А) на -0.042 и 0.028 А соответственно, а перегибы цикла по линиям С(1А)...С(2) и С(3)...С(4А) довольно малы и соответственно равны 3.4 и 1.9. Конформацию этого цикла можно представить и в виде уплощенной софы с выходом атома 0(1) из плоскости, проведенной через пять атомов цикла (плоскость выполняется с точностью 0.011 А) на -0.032 А. Необходимо отметить, что в исследованных нами ранее замещенных замещенных 4Я-пиранах ,27,144,145 гетероцикл менее уплощен и имеет конформацию ванны с более выраженными перегибами цикла. Значения двугранных углов между плоским пиррольным гетероциклом и плоским фрагментом пиранового кольца, а также фенильным заместителем (С(5А)... С(9А)) незначительны (6.4 и 4.2 соответственно) и указывают на уплощение всего трициклического фрагмента молекулы. Разворот псевдоаксиального арильного заместителя относительно плоской части пиранового цикла составляет 82.5, а поворот нитрогруппы относительно Ph-цикла на 44.2 вызван присутствием атома хлора у соседнего атома (невалентное расстояние Cl( 1)...0(3) 2.926(4) А меньше суммы ван-дер-ваальсовых радиусов атомов ). Следует отметить, что арильный заместитель повернут нитрогруппой в сторону плоскости гетероцикла, т.е. имеет анти-ориентацию по отношению к атому водорода при атоме С(4). Наблюдаемое пространственное расположение ацетильной группы приводит к невалентному взаимодействию 0(2)...Н(4А), которое, согласно 147,148, можно рассматривать как внутримолекулярный контакт (ВМК) с параметрами: С(4)...0(2)2.771(4),С(4)-Н(4А) 1.0, 0(2)...Н(4А) 2.42 А, угол С(4)-Н(4А).„ 0(2) 101. Как видно из таблицы №2, наблюдается заметное перераспределение длин связей в плоском фрагменте N(12)-C(2)=C(3)-C13=N(14), которое можно объяснить существованием сопряжения в нем. Остальные геометрические параметры исследованных соединений имеют ожидаемые значения 49. В кристалле межмолекулярные водородные связи N(12)- H(12A)...N(14) (1.5 - х, 3.5 - y,-z) [N(12)...N(14) 3.101(4), N(12)-H(12A) 0.88, H(12A)...N(14)2.27 А, угол N(12)- H(12A)...N(14) 158] и N(12)-Н(12В)...0(2) (х, 1 +у, z) [N(12)...0(2) 2.966(4), N(12)-H(12B) 0.88, Н(12В)...0(2) 2.10 А, угол N(12)-H(12B)...0(2) 166] объединяют молекулы 2q в бесконечные цепочки. Следует отметить, что атом кислорода сольватной молекулы ацетона образует довольно слабую межмолекулярную водородную связь с молекулой пирана: С(11)-Н(11С)... 0(1 W) (1 - х, у, 0,5 - z) [C(l 1)...0( 1W) 3.271(4), С(11)-Н(11С) 0.98, H(11C)...0(1W) 2.31 А, угол С(11)-Н(11С)... 0(1 W) 166].
Образование ВМК, вероятно, происходит в аддукте Михаэля 5, последующая циклизация которого приводит к образованию одного из двух возможных изомеров с аксиальным расположением фенильного заместителя. Характерной особенностью ИК- спектров аннелированных пиранов, является наличие деформационных и валентных полос поглощения амино- группы в областях 1660- 1680 см"1 и 3190-3440 см"1 соответственно. Полоса сопряженной циано- группы енаминонитрильного фрагмента пиранового цикла проявляется в области 2202-2221 см 1. Полоса поглощения карбонильной группы ацетиламидного фрагмента пирана несколько выше и находится в области 1687-1702 см 1. Это, вероятно, связано с частичным выходом ацетильной группы из плоскости сопряжения с атомом азота из-за ВМК, что, в свою очередь вытекает из данных РСА соединения 2q .
Реакции 6-метокси-2Я-бензо[6]фуран-3-она с арилметиленмалононитрилами
Оказалось, что в этом случае реакция протекает с образованием 2-амино-4-арил-1,3-дициано-7-метоксидибензо[6, /]фуранов (11) , а не ожидаемых 2-амино-4-арил(гетарил)-7-метокси-3-циано-4Я-пиран[3,2-6]бензофуранов (12) . Известно, что конденсация малононитрила 7 и ароматических альдегидов 8 (конденсация Кневенагеля) является обратимым процессом152. Тогда можно предположить, что в реакционной смеси (раствор 96 % этанола) могут присутствовать как соединения 10 и 3, так и альдегид 8 и малононитрил 7.
Вероятно, происходит конденсация малононитрила 7 с 6-метоксибензофуран-З-оном (10) и образование непредельного динитрила 13 (схема 6, путь А), который вступает в реакцию Михаэля с арилметиленмалононитрилом 3 с образованием аддукта 14, который по реакции Торпа-Циглера циклизуется в имин 15. Последующие таутомерное превращение и дегидроцианирование приводят к образованию дибензофурана 11.
По крайней мере, в ряде случаев для данной реакции может быть предположен и другой механизм, включающий на первой стадии образование 6-метокси-2-арилиден-бензофуран-3(2//)-она 17 (схема 6, путь В), в результате конденсации исходного кетона 10 и альдегида 8. Далее происходит взаимодействие двух молей малононитрила 7 с интермедиатом 17, и дальнейшее превращение интермедиата 14 в дибензофуран 11 протекает аналогично ранее приведенной схеме. Соединения 17 в ряде случаев наблюдаются в ЯМР- спектрах неочищенных продуктов реакции.
Полученные экспериментальные данные были использованы нами для разработки более простых методов синтеза замещенных дибензофуранов 11. С учетом схемы 6 соединения 11 были целенаправленно синтезированы постадийным синтезом с предварительным выделением интермедиата 17 и последующем его взаимодействием с двумя молями малононитрила 7 в этаноле.
Учитывая то, что генерация аддуктов Михаэля 14 происходит при взаимодействии с арилметиленмалононитрилом 3, логично предположить, что 2-амино-З-цианодибензофураны (11) можно получить без предварительного синтеза 6-метокси-2-арилиден-бензо[6]фуран-3(2//)-онов (17) или арилметиленмалононитрилов 3, путем трехкомпонентной конденсации 6-метоксибензо[6]фуран-3-она (10), соответствующего альдегида 8 и малононитрила 7. Действительно, взаимодействие 6-метокси-2#-бензо[&]фуран-3-она (10) с двумя молями малононитрила 7 и одним молем соответствующего альдегида (8) в этаноле в присутствии триэтиламина приводит к образованию дибензофуранов 11 (схема 8, метод С, таб. 10) с выходами аналогичными методу А.
Характерной особенностью ИК- спектров соединений 11 является наличие деформационных и валентных полос поглощения амино-группы в областях 1623- 1650 и 3180-3460 см 1 соответственно. Полосы поглощения сопряженных циано-групп енаминонитрильного фрагмента анилинового цикла проявляются в области 2208-2230 см 1. Данные ЯМР Н спектроскопии соединений также не противоречат структуре аннелированных анилинов 11. Так, наряду с сигналами протонов метокси-группы 8н (3,74-3,98 м.д.) и арильного заместителя 5н (6,68- 8,85 м.д.), в спектре ЯМР Н присутствует характерный умеренно уширенный сигнал протонов амино-группы в области 6,41- 6,60 м.д. (табл. II).
Характерной особенностью ИК- спектров соединений 17 является наличие полосы поглощения карбонильной-группы в областях 1696- 1710 см . Данные ЯМР Н спектроскопии соединений также не противоречат структуре 6-метокси-2-арилиден-бензо[Ь]фуран-3(2//)-онов 17. Так, наряду с сигналами протонов метокси-группы 8ц (3,90-3,95 м.д.) и ароматических протонов 5н (6,60- 8,01 м.д.), в спектре ЯМР Н присутствует характерный сигнал протона фрагмента (-СН=) в области 5н 7.10 м.д. (табл. 9). н,со"
Схема этой реакции может включать превращения, аналогичные ранее описанным для реакции 1-ацетил-1,2-дигидро-ЗЯ-индол-З-она с 2-арил(гетарил)-1,1-Дицианоэтиленами (3) (схема 2). Первоначально образуется аддукт Михаэля 20, который претерпевает внутримолекулярную циклизацию с образованием аминопирана 19.
Так как в обеих случаях интермедиатом, видимо, является аддукт Михаэля 20, то логично предположить, что 2-амино-4-арил-3-циано-4#-бензотиено[3,2-Л]пираны (19) можно получить более простым методом - в одну стадию без предварительного синтеза 2-арилиден-бензо[6]тиофен-3(2Я)-онов (21) или арилметиленмалононитрилов 3, путем трехкомпонентной конденсации 2#-бензо[6]тиофен-3-она (18), соответствующего альдегида 8 и малононитрила 7.
Действительно, смешение 18 с одним молем малононитрила 7 и соответствующего альдегида 8 в присутствии триэтиламина приводит к 2-амино-4-арил-4Я-бензо[4,5]тиено[3,2-6]пиран-3-карбонитрилам (19) (схема И, метод С, табл.15). С целью сравнения эффективности методов А, В, С в таблице 12 представлены выходы соединений 19, полученных по методам А, В, С.
Характерной особенностью ИК-спектров соединений 19, является наличие деформационных и валентных полос поглощения амино-группы в областях 1654- 1655 и 3215-3472 см" соответственно. Полосы поглощения сопряженных циано- групп енаминонитрильного фрагмента пиранового цикла проявляются в области 2224-2227 см"1. Аналогичная картина наблюдается в ИК-спектрах бензаннелированных 2-амино-4#-пиранов 26 29 (таб. 16).
Данные ЯМР Н спектроскопии соединений не противоречат структуре аннелированных пиранов 19. Так, наряду с сигналами протонов бензотиофенового и арильного фрагментов бн (7,30- 8,68 м.д.), в спектре ЯМР Н присутствует характерный С(4)Н сигнал в виде синглета в области 5Н (4,95- 5,07 м.д.). Сигналы протонов аминогруппы проявляются в виде синглета в области бн (7,08-7,10 м.д.) (таб. 16).
Характерной особенностью ИК- спектров соединений 21 является наличие полосы поглощения карбонильной- группы в областях 1676- 1682 см"1. Данные ЯМР !Н спектроскопии соединений также не противоречат структуре 2-арилиден-1-бензотиофенов 21. Так, наряду с сигналами протонов арилиденого фрагмента (-СН=) в области бн (6,61- 6,63 м.д.), присутствуют сигналы ароматики в области бн (7,11-7,98 м.д.) (таб. 14). Таблица 13. Физико-химические характеристики соединений 21.
Характерной особенностью ИК- спектров соединений 23 является наличие деформационных и валентных полос поглощения амино- группы в областях 1647- 1670 см и 3239-3481 см"1 соответственно. Полосы поглощения сопряженных циано- группы енаминонитрильного фрагмента пиранового цикла проявляются в области 2198-2220 см" . Аналогичная картина наблюдается в ИК- спектрах бензаннелированных 2-амино-4Я-пиранов26Л9 (таб. 19).
Данные ЯМР Н спектроскопии соединений подтверждают структуру пиранов 23. Так, наряду с сигналами арильного фрагмента 8н (6,90- 8,60 м.д.) в спектре ЯМР Н присутствует характерный С(4)Н сигнал в виде синглета в области бц (3,88- 5,42 м.д.). Сигналы протонов аминогруппы проявляются в виде уширенного синглета в области 5н (6,82- 6,96 м.д.), (таб.19).
Реакции а-тетралона с арилметиленмалононитрилами
Ранее были изучены реакции 2-арилиден-1-тетралонов 29 с малононитрилом 7 в присутствие органических оснований. Установлено, что реакции протекают с образованием 4Я-нафто[1,2-6]пиранов 30 ,6U62. Следуя целям и задачам данного исследования, мы изучили реакцию а-тетралона 31 с арилметиленмалононитрилами 3. Реакция проводилась при непродолжительном кипячении в этаноле в присутствии триэтиламина. В таких условиях реакция протекает селективно и приводит к образованию 4Я-нафто[1,2-6]пиранов 30 (схема 16, Метод А, таб. 25). Схема 16 Метод А о El3N,ElOH Д + 3h,m 26-33% 31 30h,m 3,30: 4-ClC(iH4(h).4-BrC6H4(ni), Видимо, первоначально образуется аддукт Михаэля 32 (схема 17), который претерпевает 1,2-элиминирование малононитрила 7 с образованием 2-арилиден-1-тетралона 29. Далее происходит взаимодействие малононитрила с интермедиатом 29. Аддукт Михаэля 33 в основной среде претерпевает внутримолекулярную циклизацию с образованием иминопирана 34. Дальнейшее таутомерное превращение приводит к образованию 4Я-нафто[1,2-6]пиранов 30. Соединения 29 наблюдаются в ЯМР- спектрах неочищенных продуктов реакции.
Так же вероятно, что существует и второй путь реакции- аддукт Михаэля 32 может непосредственно переходить в таутомерную форму 33, которая претерпевает превращения в 4Я-нафто[1,2-6]пираны 30 по выше описанному пути. 2.5.2 Модификация метода синтеза нафтопиранов. Ранее неописанные соединения 30d,m,w были синтезированы по ранее описанному методу ,б0,,б, заключающемуся во взаимодействии предварительно синтезированного 29d,m,w и малононитрила 7 (схема 18, метод В, таб. 25). Схема 18 Метод В 29 a,d,h,m,q,w,x + 7 Et?N EtOHA». 30 a,d,h,m,q,W,x 45-68% 29,30: Ar= С6Н5(а), 4-FC6H4(d), 4-CIC6H4(h), 4-BrC6H4(m), 4-N02C6H4(q), 4-COOCH3-C6H4(w), 4-OCH3-C6H4 (x) Нами установлено, что 4Я-нафто[1,2-6]пираны 30 можно получить более простым методом, в одну стадию, без предварительного синтеза 2-арилидентетралонов 29 или арилметиленмалононитрилов 3, путем трехкомпонентной конденсации а-тетралона 31, соответствующего альдегида 8 и малононитрила 7.
Характерной особенностью ИК- спектров соединений 29 является наличие полосы поглощения карбонильной группы в областях 1696- 1760 см 1. Данные ЯМР Н спектроскопии соединений также не противоречат структуре 2-арилиден-1-тетралонов 33. Так, наряду с сигналами протонов фрагмента -(СН2-СН2)- 5ц (2,50-3,20 м.д.) присутствуют сигналы ароматических протонов и фрагмента (-СН=) в области бн (6,98- 8,73 м.д.) (таб. 24). Характеристики полученных нами соединений 30a,h,q,x соотвествуют литературным данным 16, ш (табл. 25,26).
Характерной особенность ИК- спектров аннелированных пиранов 30 является наличие деформационных и валентных полос поглощения амино- группы в областях 1624- 1680 см и 3032-3448 см"1 соответственно. Полоса сопряженной циано- группы енаминонитрильного фрагмента пиранового цикла проявляется в области 2192-2224 см 1 (таб.26). Аналогичная картина наблюдается в ИК спектрах бензаннелированных 2-амино-4#-пиранов 29,30 . Данные ЯМР Н1 спектроскопии соединений также не противоречат структуре аннелированных пиранов 30. Так, наряду с сигналами протонов фрагмента -(СН2-СН2)- (1,78-2,90 м.д.), в спектре ЯМР Н1 присутствует характерный 4-СН сигнал в области бн (3,87- 4,60) м.д.. Характерным является умеренно уширенный сигнал протонов амино группы в области бн (6,53-7,10 )м.д. (таб.26). cdr Таблица 23. Физико-химические характеристики соединений 29.
Соединение 29 R Брутто формула Вычислено, % Т С Масс-спектр [М]+ Выход, % Найдено, % С Н N d 4-FC6H4 C,7H13FO 80.93 5.19 165-167 252 80.81 4.99 h 4-ClC6H4 С17Н13СЮ 75.98 4.88 130-132 268 75.85 4.97 m 4-BrC6H4 С17Н13ВЮ 65.19 4.18 137-139 312 314 65.25 4.29 q 4-N02C6H4 СпНпЫОз 73.11 4.69 5.02 185-187 279 73.92 4.66 4.92 w 4-COOCH3-СбН4 С19Н16О3 78.08 5.52 163-165 292 77.87 5.59 X 4-ОСНз Сі8НібОг 81.79 6.10 108-110 264 81.75 6.15 Таблица 24. Спектральные характеристики соединений 29.
Видимо, первоначально образуется аддукт Михаэля 37 (схема 21), который претерпевает 1,2-элиминирование малононитрила 7 с образованием З-арилиден- хроманона 38. Далее происходит взаимодействие малононитрила с интермедиатом 38. Аддукт Михаэля 39 в основной среде претерпевает внутримолекулярную циклизацию с образованием иминопирана 40. Дальнейшее таутомерное превращение приводит к образованию пирано[3,2-с]хромена 36. Соединение 38 наблюдаются в ЯМР- спектре неочищенного продукта реакции (таб. 28,29).
По-видимому, различие в направлении реакции «/ -непредельных нитрилов с монокарбонильными бензоаннелироваными соединениями связано с различной реакционной способностью аддуктов Михаэля, которые в большинстве случаев являются трудновыделяемыми.
Также можно предположить, что соединение, находящееся в начальный момент реакции в енольной форме (ввиду кето-енольной таутомерии), вероятно, склонно к образованию 2-амино-4Я-пиранов, а в кетонной форме - наоборот, к образованию дицианоанилинов. Предположение о существовании кето-енольной таутомерии в исходных реагентах основывается на следующих данных:
ИК спектр 1-ацетил-1,2-дигидро-ЗЯ-индол-3-она(1) свидетельствует, что соединение 1 в твердом состоянии находится в кетонной форме, поскольку присутствует поглощение карбонила при 1715 см"1 и отсутствует характерное поглощение гидроксила енола в интервале 3000-4000 см 1. ЯМР Н и 13С спектры свидетельствуют также о нахождении соединения 1 в кетонной форме (см табл. 32,34). Однако если принять во внимание данные о том, что 1-метил-1,2-дигидро-ЗЯ-индол-З-он в полярном растворителе находится преимущественно в енольной форме161, то можно предположить, что соединение 1 в начальный момент реакции также находится преимущественно в енольной форме 6-метокси-2Я-бензо[6]фуран-3-он (10), вероятно, находится в кетонной форме, поскольку в спектрах ИК, ЯМР Н и 13С отсутствуют характерные сигналы енольной формы (см. табл. 32, 34). Также принимая во внимание данные о том, что 2Я-бензо[6]фуран-3-он существует исключительно в кето-форме независимо от времени и типа растворителя ,61"164 можно предположить, что и для соединения 10 единственной таутомерной формой является кетон.











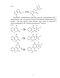






![Синтез и химические свойства R'F-содержащих 4Н-пирано[2,3-b]пиридин-4-онов и пирано[2,3-c]пиразол-4(1Н)-онов Барабанов Михаил Александрович Синтез и химические свойства R'F-содержащих 4Н-пирано[2,3-b]пиридин-4-онов и пирано[2,3-c]пиразол-4(1Н)-онов](/i/i/4443/200191.png)


![Соли 1,3-диметил-2,4-диоксо-1Н,2Н,3Н,4Н-пирано[4,3-d]пиримидиния. Синтез и реакции с нуклеофилами Коструб Владимир Владимирович Соли 1,3-диметил-2,4-диоксо-1Н,2Н,3Н,4Н-пирано[4,3-d]пиримидиния. Синтез и реакции с нуклеофилами](/i/i/4302/402003.png)
