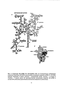Содержание к диссертации
Введение
1. Структурно-функциональная организация рибосомы в процессе элонгации 8
1.1. Структурно-функциональная организация бактериальной рибосомы
1.1.1. Общее строение рибосомы 8
1.1.2. мРНК-связывающий центр 12
1.1.3. Расположение молекул тРНК в А-, Р- и Е-участках рибосомы 16
1.1.4. Декодирование мРНК 20
1.1.4.1. Структурные основы взаимодействия кодон-специфичной тРНК в А-участке 22
1.1.4.2. Роль фактора элонгации Ти 25
1.1.5. Образование пептидной связи 27
1.1.6. Транслокация 31
1.1.6.1. Модели транслокации 31
1.1.6.2. Роль фактора G 37
1.1.7. Механизмы действия некоторых антибиотиков 40
1.1.8. Сравнение данных по структурной организации активных центров, полученных методом аффинной модификации и РСА 44
1.1.8.1. мРНК-связывающий центр 44
1.1.8.2. тРНК-связывающие участки 47
1.2. Некоторые аспекты структурно-функциональной организации рибосом эукариот 49
1.2.1. Структурно-функциональная организация рибосом дрожжей 49
1.2.2. Структурно-функциональная организация рибосом высших эукариот 52
1.2.3. мРНК-связывающий центр рибосом человека 54
1.3. Заключение 57
2. Расположение кодонов мРНК в А-, Р- и Е-участках по данным аффинной модификации рибосом человека аналогами мРНК - производными олигорибонуклеотидов с фотоактивируемой группой на остатке гетероциклического основания 59
2.1. Результаты
2.1.1. Фотоактивируемые производные олигорибонуклеотидов 59
2.1.2. Модельные комплексы 80S рибосом с аналогами мРНК 60
2.1.3. Анализ сшивок аналогов мРНК 64
2.1.3.1. Анализ сшивок с 18SpPHK 66
2.1.3.2. Анализ сшивок с тРНК 66
2.1.4. Определение участков 18S рРНК, содержащих нуклеотиды, сшитые с аналогами мРНК 69
2.1.4.1. Определение участка сшивки аналога мРНК IV с 3'-концевой последовательностью 18SpPHK 74
2.1.4.2. Определение участка сшивки аналога мРНК V с 3'-концевой последовательностью 18SpPHK 77
2.1.5. Определение нуклеотидов 18S рРНК, сшитых с аналогами мРНК 78
2.1.6. Определение белков, сшитых с аналогами мРНК I, II и III 82
2.2. Обсуждение результатов модификации 80S рибосом фотоактивируемыми производными олигорибонуклеотидов pUUUGUU и pUUAGUAUUUAUU 86
2.2.1. Взаимодействие производного pUUAGUAUUUAUU с 18S рРНК в составе комплекса с 80S рибосомой, образованного в отсутствие тРНК 87
2.2.2. А-, Р- и Е-участки мРНК-связывающего центра 80S рибосомы 89
2.2.3. Сшивки производного pUUAGUAUUUAUU с тРНК 93
2.2.4. Соотнесение данных по аффинной модификации 80S рибосом человека реакционноспособными аналогами мРНК со структурой мРНК-связывающего центра рибосом бактерий 94
2.3. Заключение 98
3. Экспериментальная часть 100
3.1. Материалы 100
3.2. Выделение рибосомных 40S и 60S субчастиц из плаценты человека 101
3.3. Синтез фотоактивируемых производных олигорибонуклеотидов, несущих перфторфенилазидогруппу на атоме N7 остатка гуанина 103
3.4. Введение радиоактивной метки на 5'-конец 104
3.5. Гидролиз РНКазой ТІ 105
3.6. Дефосфорилирование тРНК 105
3.7. Получение комплексов 80S рибосом с аналогами мРНК в присутствии тРНК 106
3.8. Фотоаффинная модификация 80S рибосом производными pUUUGUU и pUUAGUAUUUAUU 108
3.9. Разделение модифицированных 80S рибосом на субчастицы 108
3.10. Выделение рРНК из 80S рибосом 108
3.11. Установление района 18S рРНК, содержащего участок сшивки с аналогом мРНК, с помощью гидролиза РНКазой Н 109
3.12. Выделение З'-концевого фрагмента 18S рРНК, содержащего сайт сшивки с производным pUUUGUU3'OMe, и введение радиоактивной метки по 3'-концу этого фрагмента 109
3.13. Ограниченный щелочной гидролиз и гидролиз РНКазой U2 110
3.14. Определение модифицированных нуклеотидов в 18S рРНК с помощью метода обратной транскрипции 111
3.15. Определение модифицированных рибосомных белков с помощью одномерного гель-электрофореза 112
3.16. Гидролиз протеиназой К и РНКазой А 112
3.17. Определение модифицированных рибосомных белков с помощью двумерного гель-электофореза 113
Выводы 114
- Некоторые аспекты структурно-функциональной организации рибосом эукариот
- Обсуждение результатов модификации 80S рибосом фотоактивируемыми производными олигорибонуклеотидов pUUUGUU и pUUAGUAUUUAUU
- Выделение рибосомных 40S и 60S субчастиц из плаценты человека
- Ограниченный щелочной гидролиз и гидролиз РНКазой U2
Введение к работе
Изучение структурно-функциональной топографии рибосом важно не только для понимания молекулярных механизмов биосинтеза белка, но и для разработки подходов к регуляции этого процесса. К настоящему времени достигнуты значительные успехи в изучении структурно-функциональной организации рибосом бактерий [1,2], вместе с тем наблюдается отставание в изучении рибосом эукариот. По-видимому, это связано не только с меньшей доступностью рибосом эукариот (и, в частности, человека), но и с тем, что многие из методов, успешно применяемых для изучения бактериальных рибосом, пока что не могут быть использованы для исследования рибосом высших организмов. Прежде всего это касается метода РСА, так как кристаллы эукариотических рибосом пока не получены, и методов, основанных на реконструкции рибосомных субчастиц из белков и рРНК, поскольку до сих пор не найдено подходов к сборке активных субчастиц рибосом эукариот in vitro. В связи с этим, пожалуй, единственным на сегодняшний день методом, с помощью которого может быть получена детальная информация о структурной организации рибосом эукариот, является метод аффинной модификации (или, как теперь принято называть, метод аффинного химического сшивания), основанный на использовании реакционноспособных аналогов компонентов аппарата трансляции (мРНК, тРНК и т.п.), который оказался в свое время очень продуктивным при изучении бактериальных рибосом (см. обзоры [3,4]).
Лаборатория Структуры и Функции Рибосом НИБХ СО РАН является единственным в мире научным коллективом, где на протяжении ряда лет проводится систематическое исследование мРНК-связывающего центра рибосом человека с помощью метода аффинной модификации. К моменту начала настоящей работы были выявлены существенные отличия во взаимодействии мРНК с рибосомами про- и эукариот. Так, с помощью синтетических матриц, несущих остатки 4-тиоуридина, было показано, что взаимодействие мРНК с эукариотической рибосомой осуществляется за счет меньшего числа контактов с рРНК малой субчастицы. С помощью коротких аналогов мРНК -производных олигорибонуклеотидов было установлено с какими нуклеотидами 18S рРНК сближены первые нуклеотиды кодонов матрицы в Р- и Е-участках (положения +1 и -3, соответственно) и нуклеотиды, расположенные с 3 -стороны от ко дона в А-участке (положения от +7 до +13) и с 5 -стороны от кодона в Е-участке (положение -6). Было также известно, с каким нуклеотидом 18S рРНК соседствует нуклеотид мРНК, примыкающий с З -стороны к ко дону в Р-участке. Кроме того, было изучено белковое окружение первых нуклеотидов кодонов матрицы в А-, Р- и Е-участках и нуклеотидов, расположенных с 5 - и З -сторон от этих участков (см. обзоры [5,6]).
Целью настоящей работы являлось изучение окружения на 80S рибосоме человека первого нуклеотида кодона в А-участке (положение +4 относительно первого нуклеотида кодона в Р-участке) и каждого из нуклеотидов кодонов матрицы в Р- и Е-участках (положения от +3 до -3) с помощью метода аффинного химического сшивания с использованием коротких аналогов мРНК, производных олигорибонуклеотидов с фотоактивируемой группой на остатке гетероциклического основания, в составе комплексов, имитирующих различные состояния рибосомы в процессе элонгации. Основными задачами являлись:
— определение нуклеотидов 18S рРНК и рибосомных белков, сшивающихся с производными гексарибонуклеотида pUUUGUU, несущими перфторфенилазидогруппу на атоме С5 первого, второго или третьего остатка урацила, в рибосомных комплексах, где модифицированный остаток находился в положениях от +3 до -3;
— определение нуклеотидов 18S рРНК, сшивающихся с производным гексарибонуклеотида pUUUGUU, несущим перфторфенилазидогруппу на атоме N7 остатка гуанина, в рибосомных комплексах, где модифицированный остаток находился в положениях +4 и +1;
— определение нуклеотидов 18S рРНК, сшивающихся с производным додекарибонуклеотида pUUAGUAUUUAUU, несущим перфторфенилазидогруппу на атоме N7 остатка гуанина, в рибосомном комплексе, где модифицированный остаток находился в положении -3, и изучение влияния наличия и природы тРНК в Е-участке на сшивку с 18S рРНК в этом комплексе;
— сопоставление данных по фотоаффинной модификации рибосом человека производными олигорибонуклеотидов pUUUGUU и pUUAGUAUUUAUU с данными, полученными с помощью РСА, по расположению матрицы на бактериальных рибосомах.
Некоторые аспекты структурно-функциональной организации рибосом эукариот
На сегодняшний день метод крио-ЭМ является одим из основных методов, используемых для изучения пространственной организации рибосом эукариот. Сравнение пространственных моделей рибосом растений [130], дрожжей [131] и млекопитающих [132, 133], полученных с помощью крио-ЭМ с низким уровнем разрешения (25-35 А), с классической моделью 70S рибосом Е. coli позволило установить, что на поверхности обеих субчастиц на фоне головки, тела, платформы и плеча малой 40S субчастицы и коронообразной формы большой 60S субчастицы расположен дополнительный рРНК/белковый материал, соответствующий специфическим для эукариот сегментам рРНК и белкам. Максимальное разрешение, которого удалось добиться при изучении пространственной модели рибосом дрожжей с помощью крио-ЭМ, составляет 15.4 А [134]. На таком уровне разрешения видны спирали рРНК и отдельные белки, однако более тонкие черты строения рибосомы проследить невозможно. Для определения деталей строения рибосом эукариот авторы работы [134] использовали подход, основанный на наложении атомных структур рибосом бактерий на карту электронной плотности рибосом дрожжей. Для упрощения, карта плотности рибосомы дрожжей была разделена на две части, соответствующие плотностям рРНК и белков [135], на которые по отдельности накладывали пространственные атомные структуры рРНК и белков рибосом бактерий, соответственно [2, 14, 16]. Дрожжи являются промежуточным эволюционным звеном, поэтому по форме и размеру рибосома дрожжей занимает промежуточное положение между рибосомами бактерий и млекопитающих [133]. Малая 40S субчастица S. cerevisiae содержит на 11 белков больше, чем 30S субчастица Е. coli, а ее молекула 18S рРНК длинее 16S рРНК Е. coli на 256 нуклеотида [134]. Установлено, что основные изменения затрагивают периферию 40S субчастицы, тогда как ее сердцевина остается консервативной (рис.11). Так, в отличие от положения спирали HI6 16SpPHK, которая вытянута вдоль оси малой субчастицы бактериальной рибосомы, спираль Н16 18S рРНК повернута в сторону задней части 40S субчастицы и оказывается экспонированной на ее поверхности. По-видимому, такая ориентация спирали HI6 18S рРНК характерна для рибосом эукариот, поскольку такая же ориентация отмечена в 40S субчастице млекопитающих, и может быть важной для инициации трансляции [136].
По сравнению с 30S субчастицей спираль Н44 18S рРНК смещена в направлении плеча 40S субчастицы и имеет дополнительные нуклеотиды на конце (дополнительный сегмент ES12), которые образуют новый структурный элемент эукариотической рибосомы (правую ногу ) (рис. 11). Обращает на себя внимание также клюв 40S субчастицы дрожжей, который по сравнению с 30S субчастицей бактерий удлинен и имеет другую форму. Большая 60S субчастица дрожжей состоит из 45 белков и молекул 5.8S, 25S и 5S рРНК, длиной 158, 3392 и 121 нуклеотидов, соответственно [134]. Плотность, соответствующая белкам 60S субчастицы, не имеющим гомологов среди бактериальных белков, находится главным образом на периферии субчастицы. По-видимому, функция этих белков заключается в стабилизации дополнительных сегментов рРНК большой субчастицы и/или в их взаимодействии со специфическими для эукариот регуляторными и трансляционными факторами [137]. Все домены 5.8S и 25S рРНК имеют дополнительные сегменты рРНК [138], которые дискретно располагаются по поверхности большой субчастицы. Многие из этих дополнительных сегментов рРНК входят в состав межсубъединичных мостиков, за счет которых осуществляется взаимодействие субчастиц в процессе трансляции. В рибосоме малая и большая субчастицы дрожжей образуют друг с другом 11 мостиков [134], 7 из которых соответствуют межсубъединичным контактам бактериальной рибосомы [2, 12], т.е. относятся к консервативным элементам, а 4 мостика являются новыми структурными элементами, специфичными для рибосом эукариот. Наложение атомной структуры 50S субчастицы бактерий [16] на карту плотности рибосом дрожжей позволило установить, что ориентация стержня Р0/Р1/Р2 в 60S субчастице дрожжей отличается от ориентации гомологичного этому стержню комплекса белков L7/L12 в 50S субчастице бактерий [134]. Интересно, что стержень Р0/Р1/Р2, в отличие от стержня L7/L12, имеет боковой выступ, расположенный вблизи N-концевого домена белка LI 2 (гомолога белка L11 в 70S рибосоме Е. coif) [134]. С этим выступом контактирует фактор eEF-2 [139]. Замена стержня L7/L12 на стержень Р0/Р1/Р2 приводит к значительному ингибированию транлокации на 70S рибосомах, катализируемой фактором EF-G, вместе с тем в результате замены 70S рибосома становится активной в транслокации, катализируемой фактором eEF-2 [140]. Структурным объяснением этого факта, по мнению авторов [134], является наличие уникального контакта между стержнем Р0/Р1/Р2 и фактором eEF-2. Положение молекулы тРНК в Р-участке рибосомы дрожжей совпадает с аналогичным положением молекулы тРНК на рибосоме бактерий. Такое заключение было сделано на основании результатов, полученных при наложении кристаллических структур молекулы тРНК [141] и комплекса 70S рибосомы с тРНК в Р-участке [2, 8] на карту плотности 80S рибосомы с тРНК в Р-участке [134]. Установлено, что антикодоновая петля молекулы тРНК контактирует со спиралями Н24, Н30, Н31 и Н43 18S рРНК, а также с белком S16 малой субчастицы, тогда как D-петля контактирует со спиралью Н69 25 S рРНК, а Т-петля - с L11 большой субчастицы [136]. Интересно отметить, что рРНК большой субчастцы дрожжей может принимать участие в регуляции доступа различных клеточных факторов к N-концевой последовательности синтезируемого белка [137].
Установлено, что спираль дополнительного сегмента ES27 25S рРНК дрожжей, может находиться в двух различных конформациях [142]. В одной из конформаций она располагается вблизи места выхода полипептидной цепи из рибосомы и как бы блокирует выход белка, а в другой конформаций эта спираль повернута на 90 от этого участка и оказывается вблизи белка L1. Гетеротримерный мембранный белок Sec61p дрожжей, обеспечивающий котрансляционный экспорт синтезируемого белка, стабилизирует вторую конформацию спирали ES27 и тем самым способствует выходу белка из рибосомы [142]. 1.2.2. Структурно-функиональная организация рибосом высших эукариот. По сравнению с рибосомами дрожжей, рибосомы ретикулоцитов кролика содержат новые структурные элементы, большинство из которых соответствует дополнительным сегментам 28S рРНК [138] и находится на периферии большой субчастицы [143]. Сопоставление модели 80S рибосомы ретикулоцитов кролика и пространственной модели 23 S рРНК E. coli позволило соотнести эти элементы со спиралями рРНК 60S субчастицы. Установлено, что в основном все дополнительные нуклеотиды спиралей HI8/19, Н27/29, Н52, Н54, Н78, Н79 и Н63 28S рРНК расположены в непосредственной близости от стержневой структуры, схожей по пространственной организации со стержнем L1 рибосом бактерий, тогда как дополнительные нуклеотиды спиралей Н45, Н98 и HI01 находятся вблизи стержня Р0/Р1/Р2 большой субчастицы (гомологичного стержню L7/L12 в 70S рибосоме) [143]. Известно, что стержни L7/L12 и L1 важны для связывания и диссоциации молекул тРНК из рибосомы бактерий [2, 17, 77]. По-видимому, дополнительные структурные элементы вблизи стерженя Р0/Р1/Р2 большой субчастицы млекопитающих участвуют в связывании фактора eEF-І с рибосомой, в присутствии которого происходит связывание аминоацил-тРНК, а дополнительные элементы в районе стержня L1 играют определенную роль в диссоциации деацилированной тРНК из рибосомы. Следует отметить, что, как и в случае рибосом бактерий, в основе механизма, позволяющего деацилированной тРНК в Е-участке свободно диссоциировать из рибосомы, может лежать вращательное движение стерженя L1 60S субчастицы [144]. Малая субчастица рибосом ретикулоцитов кролика имеет характерные для эукариот структурные элементы, которые, как и в случае большой субчастицы, образованы за счет дополнительных сегментов 18S рРНК [138, 143]. Сопоставление модели 40S субчастицы с пространственной моделью 16S рРНК Е. coli [145] позволило определить, что правая нога тела малой субчастицы образована за счет дополнительных сегментов спиралей Н8, Н9 и Н44, тогда как основу левой ноги и задней доли составляет дополнительный сегмент спирали Н21 18S рРНК. Лопасть головки 40S образована за счет дополнительного сегмента спирали Н39, в то время как вытянутый клюв субчастицы в основном состоит из белков [143].
Обсуждение результатов модификации 80S рибосом фотоактивируемыми производными олигорибонуклеотидов pUUUGUU и pUUAGUAUUUAUU
В настоящей работе для изучения окружения нуклеотидов кодонов мРНК в А-, Р- и Е-участках рибосом человека использовали аналоги мРНК нового типа, несущие модифицирующую перфторфенилазидогруппу на одном из гетероциклических оснований - на атоме N7 остатка гуанина или атоме С5 остатка урацила. Атом N7 остатка гуанина и атом водорода при атоме С5 остатка урацила не принимают участия в Уотсон-Криковском спаривании, следовательно, введение модифицирующей группы по этим атомам не должно препятствовать участию соответствующих гетероциклических оснований в кодон-антикодоновых взаимодействиях. Однако из данных по связыванию аналогов мРНК II и III с 80S рибосомами (см. табл. 5) видно, что модифицирующая группа на атоме С5 второго и третьего остатков урацила фенилаланинового кодона затрудняет (вероятно, стерически) взаимодействие этого кодона с тРНК в Р-участке (уровень связывания аналогов II и III с рибосомами в присутствии Рпе-тРНКРНе ниже, чем таковой для модифицированного гексарибонуклеотида pUUUGUU в аналогичном комплексе). Относительно низкий уровень связывания производных гексарибонуклеотида pUUUGUU (аналоги I - IV) в комплексах, с валиновым кодоном и узнающей его тРНК в Р-участке (комплекс 3), и аналога V в аналогичном комплексе (комплекс 4), образованном в буфере с повышенной концентрацией Mg +, может быть объяснен низким сродством валинового кодона к Р-участку рибосом человека в присутствии тРНК, узнающей этот кодон, по сравнению со сродством к этому участку фенилаланинового кодона UUU в присутствии молекулы тРНКРЬе [152, 153]. Однако следует отметить, что при переходе к более физиологическим условиям в случае аналога V, состоящего из 4 кодонов, стимулирующее влияние валиновой тРНК на связывание соответствующего ей валинового кодона GUA в Р-участке усиливается и становится примерно таким же, как и в случае фенилаланиновой тРНК (см. табл. 5, уровни связывания аналога V в комплексах с валиновым и фенилаланиновым кодонами и узнающими их тРНК в Р-участке примерно одинаковые). Принимая во внимание вышесказанное, можно полагать, что в случае аналога V комплекс 5 с валиновым кодоном GUA и молекулой тРНКУа1 в Р-участке и фенилаланиновым кодоном UUU и молекулой тРНКРЬе в А-участке образуется только в более физиологических условиях, тогда как в буфере с повышенной концентрацией Mg2+ получается смесь двух комплексов - комплекса с фенилаланиновым кодоном в Р-участке (комплекс 6) и комплекса, в котором валиновый и фенилаланиновый кодоны находятся в Р- и А-участках, соответственно (комплекс 5). В пользу такого предположения свидетельствуют результаты сшивок аналога V с 18S рРНК в комплексах 4-6.
Так, уровни сшивок этого аналога с 18S рРНК практически совпадают в комплексах 4 и 5, образованных в буфере с 4 мМ Mg2+ и полиаминами, и отличаются от уровня сшивки аналога V в комплексе 6 (рис. 13г, панель справа, сравнить дорожки 4 и 5 с дорожкой 6). В то же время, уровни сшивок аналога V с 18S рРНК в комплексах 4 и 5, образованных в буфере с 13 мМ Mg2+, сильно отличаются (см. рис. 13г, панель слева, сравнить дорожки 4 и 5), а участок и нуклеотид 18S рРНК, с которыми сшивается этот аналог, одинаковые для комплексов 5 и 6, образованных в этом буфере (см. табл. 6). Следует отметить, что в более физиологических условиях (4 мМ Mg и полиамины) сродство дуплекса, образованного молекулой тРНКР1,е и фенилаланиновым кодоном, несущим сшивающую группу на атоме С5 второго или третьего остатка урадила, к Р-участку повышается по сравнению со сродством этого дуплекса к Р-участку в буфере с повышенной концентрацией Mg2+ (см. табл. 5, уровни связывания аналогов II и III в комплексах 1 и 2, образованных в буфере Б, примерно в 2-3 раза выше, чем в этих же комплексах, образованных в буфере А). 2.2.1. Взаимодействие производного pUUAGUAUUUAUU с 18S рРНК в составе комплекса с 80S рибосомой, образованного в отсутствие тРНК. Производное додекарибонуклеотида, содержащее четыре различных кодона, было способно в заметной степени связываться в мРНК-связывающем центре 80S рибосомы в отсутствие кодон-специфичной тРНК, в отличие от производных гексарибонуклеотида pUUUGUU (см. табл. 5, комплексы 9), а также других производных, состоящих из двух кодонов [148, 153], и производных додекауридилата [148, 165]. Это позволило осуществить сшивку аналога мРНК с 80S рибосомами в бинарном комплексе. Оказалось, что в бинарном комплексе модифицированный остаток гуанина этого производного контактирует с З -концевым участком 1840-1849 18S рРНК и в меньшей степени с районом 391-655 18S рРНК (см. табл. 6). В 16S рРНК Е. coli последовательности 1840-1849 18S рРНК соответствует участок 1508-1517 [22,115], принадлежащий спирали Н45, с которым не сшивался ни один из аналогов мРНК, используемых для изучения рибосом Е. coli. С другой стороны, с 3 -районом 16S рРНК, расположенным в односпиральном участке вблизи нуклеотида G1530 [115], сшивались синтетические мРНК (длиной до 50 нуклеотидов), несущие остаток 4-тиоуридина с 5 -стороны от первого нуклеотида в Р-участке, причем сшивки с этим районом рРНК усиливались в присутствии тРНК [108, 111].
Очевидно, что сшивка матрицы с районом G1530 отражает наличие контактов, необходимых для правильной ориентации 5 - области мРНК (по отношению к кодону в Р-участке), нефиксированной кодон-антикодоновыми взаимодействиями на рибосомах бактерий. По-видимому, при связывании мРНК с эукариотическими рибосомами также имеет место взаимодействие между З -концом рРНК малой субчастицы и 5 -областью мРНК (см., например, [166]), а сшивка производного pUUAGUAUUUAUU с участком 1840-1849 18S рРНК в составе бинарного комплекса отражает это взаимодействие. Однако, в отличие от сшивки матрицы с районом G1530 16S рРНК в комплексах с 70S рибосомами [111], сшивка производного pUUAGUAUUUAUU с участком 1840-1849 18S рРНК (а также с участком 391-655) не усиливалась в комплексах 80S рибосом, стабилизированных кодон-антикодоновым взаимодействием. Возможно, это связано с тем, что образование кодон-антикодонового дуплекса затрудняло контакт фотоактивирумой группы на остатке гуанина с участком 1840-1849 18S рРНК. Альтернативным объяснением является то, что область А-, Р- и Е-участков, где связывается производное pUUAGUAUUUAUU в составе комплексов 4-8 несколько удалена от участка 80S рибосомы, контактирующего с этим производным в отсутствие тРНК. В пользу последнего предположения свидетельствует тот факт, что производные pUUUGUU с фотоактивируемой группой на первом остатке урацила (аналог I) или остатке гуанина (аналог IV), а также производные олигорибонуклеотидов с реакционноспособной группой на 5 -концевом фосфате [150, 152, 153] не сшивались с участком 1840-1849 18S рРНК (сшивок с 5 -концевым районом 372-674 также не наблюдали) в составе комплексов с модифицированным нуклеотидом в положении +1 или -3 (см. табл. 6). На этом основании модификацию в 3 - и 5 -концевых доменах 18S рРНК, сшитой с производным pUUAGUAUUUAUU в комплексах 4-8, можно отнести за счет присутствия некоторого количества бинарного комплекса в реакционных смесях, подвергавшихся УФ-облучению. При этом в смеси, содержащей комплекс 4, концентрация бинарного комплекса, по-видимому, была сопоставима с концентрацией комплекса 4. 2.2.2. А-, Р- и Е-участки мРНК-связывающего центра 80S рибосомы. Как следует из результатов по сшивкам производного pUUUGUU, несущего перфторфенилазидогруппу на остатке гуанина, первый нуклеотид кодона в А-участке (положение +4) соседствует с основаниями А1823, А1824 и А1825 З -концевого домена 18S рРНК (см. рис. 20а и табл. 6) [22]. Появление молекулы тРНК в А-участке не приводит к изменениям в окружении первого нуклеотида кодона в этом участке, а лишь частично экранирует основания А1823, А1824 и А1825 18S рРНК от модификации (рис. 20а, сравнить дорожки 1 и 2). Ранее было показано, что это производное в аналогичном комплексе сшивается также с белком S15 и в незначительной степени с белками S2 и S30, но эффективность сшивки с белками ниже, чем с 18S рРНК [158].
Выделение рибосомных 40S и 60S субчастиц из плаценты человека
Рибосомные 40S и 60S субчастицы с интактной рРНК выделяли из нормальной послеродовой плаценты. Промежуток времени между родами и гомогенизацией ткани не превышал 30 мин. Плаценту немедленно погружали в 500 мл буфера I (20 мМ Трис-НС1, рН 7.5, 125 мМ КС1, 10 мМ MgCb, 0.5 мМ EDTA, 4 мМ 2-меркаптоэтанол), который предварительно охлаждали до 4С. Не позже, чем через 20 мин после родов, плаценту резали на кусочки по 25-30 г, освобождаясь при этом от мембран и соединительной ткани, отмывали от крови в буфере I и суспендировали при 4С в равном по весу количестве буфера I, содержащего 250 мМ сахарозу, 1 г/л гепарина и 0.05 г/л циклогексимида. Полученный гомогенат центрифугировали на центрифуге «Beckman J2-21M» (ротор JA-14) при 4С и 13000 об/мин в течение 30 мин. К постмитохондриальному супернатанту добавляли дезоксихолат натрия до концентрации 1% и перемешивали в течение 30 мин при 4С. Постмитохондриальный супернатант, обработанный дезоксихолатом, наносили на сахарозную подушку (35%-ный раствор сахарозы в буфере 20 мМ Трис-HCl, рН 7.5, содержащем 100 мМ NH4CI, 3 мМ MgCh, 0.15 мМ EDTA, 5 мМ 2-меркаптоэтанол) и центрифугировали при 4С 20 ч (центрифуга «Beckman L8M», ротор SW-28, 26000 об/мин). По окончании центрифугирования супернатант осторожно сливали. Осадок полисом растворяли при 4С в 10 мл буфера 20 мМ Трис-HCl, рН 7.5, содержащего 100 мМ NH4CI, 3 мМ MgCh, 0.125 мМ EDTA и 10 мМ 2-меркаптоэтанол; нерастворившийся материал удаляли центрифугированием (центрифуга «Beckman J2-21M», ротор JA-20, 17000 об/мин, 15 мин, 4С). Раствор полисом обрабатывали 0.5 мМ пуромицином 10 мин при 0С, затем к раствору добавляли по каплям при постоянном помешивании З М КС1 до концентрации 0.5 М и инкубировали 20 мин при 37С, после чего раствор наносили на линейный градиент плотности сахарозы (10 - 30%) в буфере 20 мМ Трис-HCl, рН 7.5, содержащем 500 мМ КС1, 3 мМ MgCb, 0.125 мМ EDTA и 10 мМ 2-меркаптоэтанол, и центрифугировали 18 ч при 4С (ультрацентрифуга «Beckman L8M», ротор SW-28, 20000 об/мин). Фракции, соответствующие 40S и 60S субчастицам, осаждали центрифугированием (центрифуга «Beckman L8M», ротор SW-28, 24000 об/мин, 22 ч, 4С), предварительно повысив концентрацию Mg2+ до 20 мМ и снизив концентрацию КС1 до 120 мМ.
Осадки растворяли в воде до концентрации 80-120 ОЕгбо/мл и хранили в жидком азоте порциями по 25 мкл. Перед использованием к 40S и 60S субчастицам добавляли V объема пятикратного буфера А (однократный буфер А: 20 мМ Трис-HCl, рН 7.5, 120 мМ КС1, 13 мМ MgCl2, 0.65 мМ EDTA) или буфера Б (однократный буфер Б: 20 мМ HEPES-NaOH, рН 7.5, 100 мМ NH4CI, 4 мМ MgCl2, 0.15 мМ EDTA, 0.6 мМ спермидин, 0.8 мМ спермин) до концентрации субчастиц 15-20 ОЕгбо/мл, реактивировали в течение 10 мин при 37С, осветляли центрифугированием в течение 1 мин при комнатной температуре при 14000 об/мин и замеряли оптическую плотность, полагая, что 1 ОЕгбо соответствует 50 пмоль 40S или 25 пмоль 60S субчастиц по данным [171]. Для получения 80S рибосом субчастицы смешивали в мольном соотношении 40S:60S = 1:1.3, при этом, как показал анализ 80S рибосом в линейном градиенте плотности сахарозы (10 - 30%) в буфере А (центрифуга «Beckman L8M», ротор SW-40, 24000 об/мин, 19 ч, 4С), практически все 40S субчастицы ассоциируют с 60S субчастицами. Конечная концентрация реактивированного препарата 80S рибосом составляла примерно 10"6 М. Активность 80S рибосом в поли(Ц)-зависимом связывании [14C]PhePHKPhe измеряли по методике, описанной в работе [172], она составляла примерно 70% (т.е. около 1.4 моль [14C]PhePHKPhe связывалось с 1 моль 80S рибосом). 3.3. Синтез фотоактивируемых производных олигорибонуклеотидов, несущих перфторфенилазидогруппу на атоме N7 остатка гуанина. Присоединение перфторфенилазидогруппы по атому N7 остатка гуанина олигорибонуклеотидов UUUGUU (UUUGUU3 OMe) и UUAGUAUUUAUU проводили в две стадии. Вначале олигорибонуклеотиды алкилировали, инкубируя 0.5 ОЕ260 UUUGUU (UUUGUU3 OMe) с 400 нмоль C1RCH2NH2 в 160 мкл 8 мМ Трис-HCl, рН 7.5, в течение 5 ч при 37С или 0.66 ОЕ2бо UUAGUAUUUAUU с 24 нмоль C1RCH2NH2 в 120 мкл 8 мМ Трис-НС1, рН 7.5, в течение 2 ч при 47С. Продукты алкилирования выделяли с помощью офВЭЖХ на микроколонке объёмом 200 мкл со смолой Nucleosil 5С18 (элюция ступенчатым градиентом концентрации 10, 20, 30,40 и 90%-ного метанола в 50 мМ ТЭА-ацетате, рН 7.5, 24 мин, скорость элюции 100 мкл/мин). Элюция алкилированных олигорибонуклеотидов происходила при несколько более высокой концентрации метанола (54%-ной в случае UUUGUU и 60%-ной в случае UUAGUAUUUAUU), чем элюция исходных олигорибонуклеотидов. Степень модификации олигорибонуклеотидов составляла 90%. Фракцию, содержащую алкилированный олигорибонуклеотид, упаривали досуха в вакууме, растворяли в 5 мкл Н20, затем к этому раствору добавляли 10 мкл DMSO и обрабатывали N-гидроксисукцинимидным эфиром л-азидотетрафторбензойной кислоты (NSu-Az), как описано в [152]. Для этого отдельно растворяли 1.8 мг NSu-Az в 20 мкл DMSO и полученный раствор порциями добавляли к раствору алкилированного олигорибонуклеотида при комнатной температуре через каждые полчаса (сначала 10 мкл, затем два раза по 5 мкл). После окончания реакции к смеси в качестве носителя добавляли 1 мкл 0.1 М АТР и нуклеотидный материал осаждали 10 объёмами 2%-ного LiClQ» в ацетоне.
Осадок отделяли центрифугированием при 14000 об/мин в течение 3-5 мин при комнатной температуре, высушивали в течение 10-15 мин и растворяли в 40 мкл НгО. Затем проводили повторное переосаждение, как указано выше. Осадок сушили на воздухе в течение 15-20 мин, растворяли в 20 мкл НгО. Фотоактивируемые производные олигорибонуклеотидов выделяли с помощью офВЭЖХ, как описано выше. Элюция фотоактивируемых производных происходила при несколько большей концентрации метанола (72%-ной в случае UUUGUU и 76%-ной в случае UUAGUAUUUAUU), чем элюция алкилированных олигорибонуклеотидов, из-за наличия гидрофобной перфторфенилазидогруппы. Выход продуктов, содержащих перфторфенилазидогруппу, по отношению к алкилированным олигорибонуклеотидам составлял около 90%. При расчете молярной экстинкции фотоактивируемых производных олигорибонуклеотидов полагали, что молярная экстинкция перфторфенилазидной части реагента равна 8.6»103 моль см 1 [173]. 3.4. Введение радиоактивной метки на 5 -конец. Введение метки 32Р на 5 -конец олигорибонуклеотидов и их производных, тРНК и ОДН проводили с помощью [у-32Р]АТР и Т4 полинуклеотидкиназы. Для этого реакционную смесь объемом 20 мкл, содержащую 100 мМ Трис-HCl, рН 7.5, 60 мМ MgCh, 1 мМ EDTA, 0.5-1.5 нмоль олигорибонуклеотида (0.2 нмоль ОДН или 0.4 нмоль тРНК), 10-20 МБк [у-32Р]АТР и 15 ед. акт. Т4 полинуклеотидкиназы, инкубировали в течение 30 мин при 37С. Затем в случае олигорибонуклеотидов и их производных к смеси добавляли примерно 1 мкмоль нерадиоактивного АТР и дополнительно инкубировали 15 мин при 37С. Во всех случаях нуклеотидный материал осаждали 10 объёмами 2%-ного ІЛСЮ4 в ацетоне и выделяли офВЭЖХ, как описано в разделе 3.3. Удельная активность меченых олигорибонуклеотидов и их производных была (50-100)» 103 имп/мин на пмоль, тРНК- (30-50)-103 имп/мин на пмоль, а ОДН - (5-10)«105 имп/мин на пмоль по Черенкову. 3.5. Гидролиз РНКазой ТІ. Примерно 100 пмоль меченного 32Р исходного или алкилированного олигорибонуклеотида (pUUUGUU или pUUAGUAUUUAUU) (см. раздел 3.4) инкубировали в 15 мкл 20 мМ цитрата натрия, рН 5.0, содержащего 250 мкг/мл суммарной тРНК Е. coli, в течение 15 мин при 55С. Затем к смеси добавляли 0.5 ед. акт. РНКазы ТІ и дополнительно инкубировали 15 мин при 55С. Продукты гидролиза осаждали 10 объемами 2%-ного ЫСЮ4 в ацетоне (см. раздел 3.3), осадок растворяли в 4 мкл деионизованного формамида, содержащего 0.01%-ный бромфеноловый синий и 0.01%-ный ксиленцианол. Полученный раствор инкубировали в течение 1 мин при 90С, охлаждали во льду до 0С и анализировали с помощью электрофореза в 20%-ном ПААГ, содержащем 0.4%-ный бис-акриламид и 8 М мочевину в буфере ТБЕ (89 мМ Трис-борат, рН 8.3, 89 мМ борная кислота, 2 мМ EDTA).
Ограниченный щелочной гидролиз и гидролиз РНКазой U2
Меченый по З -концу фрагмент рРНК (10 пмоль) (см. раздел 3.12) инкубировали в 10 мкл 50 мМ NaHCCb, рН 8.9, содержащего 250 мкг/мл суммарной тРНК Е. coli, в течение 2 мин при 90С, после чего реакционную смесь выдерживали во льду 3-5 мин. В параллельных экспериментах 10 пмоль меченого по З -концу фрагмента рРНК инкубировали в 10 мкл 20 мМ цитрата натрия, рН 3.5, содержащего 250 мкг/мл суммарной тРНК Е. coli, в течение 15 мин при 55С; затем добавляли 1 ед.акт. РНКазы U2 и еще раз инкубировали 15 мин при 55С. Продукты гидролиза осаждали в виде литиевой соли, как описано в разделе 3.3, и анализировали с помощью электрофореза в 10%-ном ПААГ в денатурирующих условиях (раздел 3.5). Гель сушили в вакууме и радиоавтографировали на рентгеновскую пленку. Нуклеотиды 18S рРНК, с которыми сшивались аналоги мРНК, определяли по [174]. Для этого использовали модифицированную 18S рРНК, выделенную фенольной депротеинизацией (раздел 3.10) из облученных комплексов, и контрольную 18S рРНК, выделенную из облученных 80S рибосом. В качестве праймеров для обратной транскрипции использовали синтетические меченные 32Р по 5 -концу (см. раздел 3.4) ОДН, комплементарные различным последовательностям 18S рРНК. Сначала 1 пмоль праймера упаривали досуха в вакууме с 1 пмоль 18S рРНК. Затем проводили отжиг праймера с 18S рРНК в 1 мкл буфера 80 мМ PIPES, рН 7.5, содержащего 80%-ный формамид, 0.8 М NaCl и 0.2 мМ EDTA, при 45С в течение 10 мин, после чего смесь помещали в лёд на 3-5 мин. К охлажденным пробам добавляли по 20 мкл буфера 50 мМ Трис-HCl, рН 8.3, содержащего 40 мМ КС1, 6 мМ MgCl2, 10 мМ DTT, смесь дезоксирибонуклеозидтрифосфатов (0.5 мМ концентрация по каждому из четырёх компонентов) и 2 ед. акт. AMV-ревертазы. Синтез ДНК проводили при 42С в течение 10 мин и останавливали добавлением к реакционной смеси 20 мкл воды и 40 мкл водонасыщенного фенола. В параллельных экспериментах проводили секвенирование 18S рРНК по методу Сэнгера. Для этого использовали 18S рРНК, выделенную из немодифицированных 40S субчастиц (см. раздел 3.10), отжигали с меченым праймером и инкубировали в тех же условиях, как описано выше, предварительно добавив к реакционной смеси по 1 мкл 1 мМ водного раствора одного из дидезоксирибонуклеозидтрифосфатов (dTTP, ddGTP, ddCTP или ddATP).
Во всех случаях нуклеотидный материал экстрагировали равным объемом водонасыщенного фенола. Следы фенола из водной фазы удаляли трехкратным объемом серного эфира, после чего проводили гидролиз РНК 60 мМ NaOH при 45С в течение 1 ч. ДНК осаждали, как описано в разделе 3.6, в присутствии 4 мг/мл в течение 4-6 ч при -20С и анализировали с помощью гель-электрофореза в 8 или 9%-ном ПААГ в денатурирующих условиях (раздел 3.5). Гель сушили в вакууме и радиоавтографировали. Модифицированные 40S субчастицы (20-40 пмоль) осаждали центрифугированием (раздел 3.9), растворяли в 100 мкл буфера 20 мМ Трис-HCl, рН 7.5, содержащего 2 мМ EDTA и 1%-ный SDS, и инкубировали при 37С в течение 10 мин. Затем к полученной смеси 18S рРНК и белков добавляли 6 объёмов ацетона и выдерживали 4-6 ч при -20С. Осадок отделяли центрифугированием (13000 об/мин, 6 мин, 2С), растворяли в буфере для нанесения (60 мМ Трис-HCl, рН 6.8, 20%-ный глицерин, 0.05%-ный бромфеноловый синий, 1%-ный 2-меркаптоэтанол, 2%-ный SDS), инкубировали 10 мин при 60С и анализировали с помощью одномерного электрофореза в ПААГ по методу Лэммли [175]. Для этого использовали ступенчатый ПААГ, состоящий из 15%-ного разделяющего (375 мМ Трис-HCl, рН 8.8, 0.1%-ый SDS) и 4.5%-ного концентрирующего (125 мМ Трис-НСІ, рН 6.8, 0.1%-ный SDS) гелей, применяя в качестве электродного буфера 25 мМ Трис-НСІ, рН 8.3, содержащий 0.1%-ный SDS и 192 мМ глицин. Электрофорез прекращали после выхода бромфенолового синего из геля. После разделения белков гель окрашивали кумасси бриллиантовым голубым (0.1%-ный кумасси бриллиантовый голубой в 20%-ном этаноле и 7.5%-ной уксусной кислоте), фиксировали в 10%-ном глицерине, высушивали в вакууме и радиоавтографировали. 3.16. Гидролиз протеиназой К и РНКазой А. Осадок, содержащий смесь 18S рРНК и белков 40S субчастицы (раздел 3.15), растворяли в 20 мкл буфера 40 мМ Трис-НСІ, рН 7.5, содержащего 8 М мочевину, и инкубировали 10 мин при 37С. Затем половину прогретой смеси (10 мкл) инкубировали в 100 мкл буфера 50 мМ Трис-НСІ, рН 7.5, содержащего 100 мМ КС1, 0.8 М мочевину и 10 мкг протеиназы К, 10 мин при 37С. В параллельных экспериментах вторую половину прогретой смеси 18S рРНК и белков (10 мкл) разбавляли водой в два раза до концентрации мочевины 4 М и Трис-НСІ, рН 7.5, 20 мМ, добавляли 1 мкл 10 мкг/мкл раствора РНКазы А и инкубировали в течение 4 ч при 37С. Реакционные смеси (после обработки протеиназой К и РНКазой А) осаждали 6 объемами ацетона (при -20С в течение 4-6 ч), осадки отделяли центрифугированием (13000 об/мин, 6 мин, 2С), растворяли в буфере для нанесения, прогревали и анализировали по методу Лэммли (раздел 3.15). 3.17.
Определение модифицированных рибосомных белков с помощью двумерного гель-электрофореза. Модифицированные белки 40S субчастицы, после обработки РНКазой А и осажденные ацетоном (см. раздел 3.16), растворяли в 3 мкл буфера для нанесения (20 мМ Трис-НзВОз, рН 8.3, 1 мМ EDTA, 8 М мочевина, 1%-ный 2-меркаптоэтанол, 0.01%-ный пиронин-G) и анализировали с помощью двумерного электрофореза в ПААГ, как описано в [176]. Предварительно к каждой пробе модифицированных белков в качестве носителя добавляли по 100-150 пмоль белков 40S субчастицы, растворенных в том же буфере для нанесения. Разделение в первом направлении (8%-ный акриламид, 0.132%-ный бисакриламид, 8М мочевина, 10 мМ EDTA, 200 мМ Трис-НзВОз, рН 8.6) проводили в стеклянных трубках с внутренним диаметром 1 мм при токе 0.5 мА в течение 2 ч (верхний электродный буфер: 60 мМ Трис-НзВОз, рН 8.3,3 мМ EDTA; нижний электродный буфер: 60 мМ Трис-НзВОз, рН 8.6, 3 мМ EDTA). После разделения белков проводили диализ геля против буфера 40 мМ бис-Трис-НАс, рН 6.0, содержащего 6 М мочевину, 1%-ный SDS, 1%-ный 2-меркаптоэтанол и 0.1%-ный бромфеноловый синий, в течение 20 мин. Затем гель наслаивали на гель для электрофореза во втором направлении. Разделение белков проводили в присутствии SDS (разделяющий гель: 12.5%-ный акриламид, 0.25%-ный бисакриламид, 6 М мочевина, 100 мМ бис-Трис-НАс, рН 6.75; концентрирующий гель: 4%-ный акриламид, 0.07% бисакриламид, 6 М мочевина, 40 мМ бис-Трис-НАс, рН 6.0, 0.2%-ый SDS; верхний электродный буфер: 50 мМ бис-Трис-MES, рН 6.5, 0.2%-ный SDS, 0.02%-ная тиогликолевая кислота; нижний электродный буфер: 20 мМ бис-Трис-НАс, рН 6.75). Электрофорез проводили до выхода бромфенолового синего из геля. Гель окрашивали кумасси бриллиантовым голубым, как описано в разделе 3.15, фиксировали в 10%-ном глицерине, высушивали в вакууме и радиоавтографировали. выводы 1. Изучено окружение на 80S рибосоме кодонов мРНК в А-, Р- и Е-участках с помощью аффинной модификации рибосом человека аналогами мРНК — фотоактивируемыми производными олигорибонуклеотидов, несущими перфторфенилазидогруппу на остатке гетероциклического основания. а) Определены нуклеотиды 18S рРНК и рибосомные белки, сшивающиеся с производными гексарибонуклеотида pUUUGUU с перфторфенилазидогруппой на атоме С5 первого, второго или третьего остатка урацила в модельных комплексах, где модифицированный остаток находился в положениях от +3 до -3 относительно первого нуклеотида кодона в Р-участке: — показано, что модификации во всех случаях подвергается исключительно 40S субчастица, а в её составе - как 18S рРНК, так и белки; — установлено, что модифицированный остаток урацила в положениях от -1 до +3 сшивается с нуклеотидом G1207 18S рРНК, а в положениях -2 и -3 - с G961; — обнаружено, что во всех изученных комплексах производные pUUUGUU модифицируют белки S2 и S3, сшивка с которыми происходит и в отсутствие тРНК; — установлено, что модифицированный остаток урацила в положении +1 сшивается с белком S26 и в незначительной степени с белком S23, а в положении -3 - также с белком S26 и в незначительной степени с белком S5/S7.