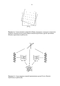Содержание к диссертации
Введение
ГЛАВА 1. Литературный обзор 4
1.1 Упаковка длинных а-спиралей в белках 4
1.2 Гидрофильные взаимодействия в белках 21
ГЛАВА 2. Результаты и обсуждения 39
2.1 Постановка задачи 39
2.2 Спрятанные гидрофильные остатки в белках как фактор, определяющий нативную упаковку спиралей 40
2.3 Стереохимический анализ гидрофильных взаимодействий в а-спиральных белках с различными упаковками а-спиралей...53
2.4 Взаимосвязь между геометрическими параметрами межспиральных водородных и солевых связей и типами остатков, которые в них участвуют 62
2.5 Моделирование «нативных» и «ненативных» межспиральных взаимодействий 75
2.6 Вероятность образования разных типов межсииральных связей. Вероятность образования межспиральных солевых мостиков в зависимости от доступности заряженных остатков. Доступность доноров и акцепторов в межспиральных связях 90
Основные результаты и выводы 92
Список литературы 93
- Упаковка длинных а-спиралей в белках
- Гидрофильные взаимодействия в белках
- Спрятанные гидрофильные остатки в белках как фактор, определяющий нативную упаковку спиралей
- Моделирование «нативных» и «ненативных» межспиральных взаимодействий
Введение к работе
Предсказание третичной структуры белка по его аминокислотной последовательности продолжает оставаться одной из важнейших задач структурной биологии. Для ее успешного решения требуется учесть все многочисленные физико-химические факторы, определяющие взаимодействия белка как с окружающей средой, так и внутри макромолекулы. Существуют многочисленные экспериментальные методы определения энергии тех или иных (гидрофобных, полярных и т.д.) взаимодействий в белках, однако все они чрезвычайно трудоемки, а так же недостаточно точны и универсальны. Целью данной работы была разработка теоретических методов и подходов для учета полярных взаимодействий (водородных связей и солевых мостиков) в белках. В качестве основного объекта исследования были выбраны а-спиральные белки с параллельной и антипараллельной упаковкой спиралей, - это довольно обширный класс белков, обладающий относительно простой архитектурой, что делает их чрезвычайно удобным объектом для структурного анализа.
В ходе нашей работы нами были рассмотрены общие черты организации а-спиральных олигомеров и а-спиральных пучков и выявлено определяющее влияние двух типов полярных взаимодействий - спрятанных водородных связей и солевых мостиков. Нами был так же предложен оригинальный метод учета относительного вклада различных полярных взаимодействий в формирование нативнои структуры. Материалы диссертации докладывались на научных конференциях. По теме диссертации опубликовано две печатные работы, не считая тезисов конференций, и одна работа принята в печать.
Упаковка длинных а-спиралей в белках
Первая такая модель была предложена Криком в его классической работе, посвященной упаковке а-спиралей [1]. В ней он рассматривал боковые цепи аминокислот, независимо от их формы и размеров, в виде шаров, имеющих радиусы в 5 А и жестко связанных с цилиндрическим остовом спирали. Согласно этой модели, при объединении спиралей для достижения плотной упаковки каждая боковая цепь одной спирали должна помещаться в углубление между четырьмя шарами на поверхности другой спирали. Чтобы такая картина наблюдалась на всем протяжении контактирующих поверхностей а-спиралей, они должны располагаться относительно друг друга под совершенно определенными углами в 20 (рис. 1.1). или -70 между их осями. Эта модель упаковки спиралей не только объяснила рефлексы рентгенограмм некоторых известных на тот момент фибриллярных белков, но и предсказала два класса взаимных ориентации спиралей в глобулярных белках. Крик назвал этот тип упаковки «knobs-into-holes» (выступ-во-впадину).
Позднее Чотиа, Левитт и Ричардсон [2, 3], взяв за основу модель Крика, предложили свою схему упаковки спиралей. Поверхность а-спиралей они описали в терминах рядов боковых цепей. Один ряд образуется остатками і, і±3, І±6, ...i±3n, второй - і, і±4, і±8,...і±4п, третий - і, і±1. В грубом приближении эти ряды представляют собою «хребты», а углубления между ними - «желобки». Плотная упаковка а-спиралей имеет место, когда «хребты» входят в «желобки» (рис. 1.2), и возможна при трех дискретных значениях углов между осями спиралей:2= -80, 1= -60 и != 19"(здесь и далее угол Q - это торсионный угол между осями контактирующих а-спиралей). Эта модель удовлетворительно описывает экспериментальные данные для целого ряда а-белков. Впоследствии авторы внесли в нее целый ряд дополнений и уточнений. В частности, в более поздней работе [3] значения трех дискретных углов П, соответствующих трем идеальным типам упаковки, уточнены до -105, -52 и +23 соответственно. Однако ценность этого теоретического уточнения представляется довольно сомнительной, если принять во внимание то, в каких пределах могут варьировать в белках геометрические параметры реальных спиралей. По аналогии с названием, предложенным Криком, эта группа исследователей назвала описанную ими упаковку спиралей «ridges into grooves» (хребты в желобки).
В 1996 г Уолтер, Айзенхабер и Аргос [4] предложили свою модель упаковки а-спиралей в глобулярных белках, так называемую «модель наложения спиральных решеток». Базируясь, по существу, на тех же предпосылках, что и Крик, они рассматривают область контакта двух спиралей как область наложения двух решеток, в узлах которых находятся аминокислотные остатки. Взаимодействие этих остатков и ограничивает подвижность спиралей, форма которых аппроксимирована цилиндром. С помощью сложного математического аппарата, используя геометрические параметры идеальной спирали и аминокислотных остатков, они выводят уравнение, имеющее три дискретных решения, соответствующих трем углам Q. Для идеальных спиралей эти три оптимальных угла равны 1= -37,1; -97,4 и +22,0. Главный вывод, который делают авторы на основании своих расчетов: упаковка а-спиралей в белках лучше описывается моделью "выступ во впадину1 (knobs into holes), чем моделью «гребень в желоб» (ridges into grooves). Геометрический анализ, проделанный авторами сложен и даже изощрен, но в какой степени эта теория, разработанная для описания взаимодействий «идеальных» спиралей, может быть применена к реальным а-спиралям в реальных белках? Удовлетворительного ответа на этот немаловажный в практическом плане вопрос авторы не дают.
Хотя опубликованная Криком модель упаковки а-спиралей уже отпраздновала свое пятидесятилетие, до сих пор появляются публикации авторов, использующих и развивающих предложенный им подход. Так в своей недавней статье Уолшоу и Вулфсон используют именно криковскую модель для описания упаковок спиралей в белках (рис. 1.3). Распространяя предложенный Криком подход на пучки состоящие из трех и более спиралей, они вводят понятие циклическая комплементарность выступов и впадин ("cyclic complementarity of knobs-into-holes») для описания упаковок 3-,4-, и 5-спиральных пучков. [5]
В 1988 году вышла в свет работа Мурзина и Финкельштейна [6], посвященная структурной систематизации а-спиральных белков. В модели, предложенной авторами, спирали накладывались на ребра квазисферических многогранников. Авторы исходили из того, что правильный многогранник, как высоко-симметричное закрытое геометрическое тело, это как раз то, к чему должна стремиться упаковка спиралей вокруг гидрофобного ядра. Данная модель предсказывала наличие лишь небольшого числа стабильных архитектур для а-спиралей в глобулярных белках и описывала геометрию упаковки а-спиралей (рис. 1.4). Она показала высокое соответствие известным белковым структурам. Более того, даже для тех белков, которые не являются гомологами, но чьи структуры описываются одним и тем же многогранником, среднеквадратичное отклонение в положениях С-а атомов лежит в границах 1,6-3А, что сопоставимо с величиной разрешения метода рентгенструктурного анализа. То обстоятельство, что в данной модели авторы оперируют спиралями как простыми геометрическими телами, подчиненными лишь одному принципу - принципу плотной упаковки позволяет отнести их модель к данной группе моделей, хотя следует отметить, что в ряду статей, посвященных проблемам упаковки спиралей, эта работа стоит особняком.
Гидрофильные взаимодействия в белках
Путем многочисленных экспериментов было показано, что существует взаимосвязь между типом гидрофобного кластера на поверхности спирали и степенью олигомеризации сс-белка. Природный белок GCN4 -димер, однако его мутантные формы демонстрируют различную степень олигомеризации, в зависимости от того, какие гидрофобные остатки находятся Band позицях (остатки в остальных положениях в ходе этих экспериментов не изменялись). Так синтетический аналог GCN4 , имеющий остатки изолейцина в а-позиции и лейцина в d-позиции, формирует димер. Мутанты с ядром из остатков изолейцина Band позициях (синтетический белок р-П) и лейцина Band позициях (синтетический белок coil-Ser) образуют тримеры, а белок с ядром из остатков лейцина в а-позиции и изолейцина в d-позиции образует тетрамер. [27,28, 29]. Кор из одних остатков изолейцина в обеих гидрофобных позициях способствует образованию тримера [27]. Замена остатков лейцина в позиции а на изолейцин или валин дополнительно стабилизирует димерный лейциновый зиппер (в сравнении с белком дикого типа ), так же как и замена валина на изолейцин в любой из гидрофобных позиций [30]. На основании анализа олигомерности ряда пептидов на основе лейцинового зиппера, но с различными остатками в гидрофобных позициях были сформулированы правила олигомерности ее- белков [28]. Эти правила уже нашли свое применение в белковой инженерии и синтезе искусственных сс-белков, однако, к сожалению, они мало применимы для анализа и успешного моделирования глобулярных белков, которые, как правило, имеют более сложный аминокислотный состав без выраженных повторов.
Важную роль в определении степени олигомерности сс-белков играет также степень гидрофобности остатков в е, g позициях. В тетрамерах эти позиции часто занимают гидрофобные остатки, в то время как в димерах почти исключительно гидрофильные. Таким образом, можно утверждать, что гидрофобные взаимодействия определяют преимущественно стереохимию упаковки спиралей в сс-белках, но (как это будет показано дальше) не их взаимное расположение (параллельное или антипараллельное). Что же касается вклада гидрофильных взаимодействий в формирование нативных упаковок сс-белков, то об этом будет сказано ниже в разделе, посвященном гидрофильным взаимодействиям в белках. В белках встречается два основных типа гидрофильных взаимодействий - это солевые мостики и водородные связи (рис. 1.11). Они играют важнейшую роль в таких молекулярно-биологических явлениях, как адсорбция, катализ, активность ферментов и, как это будет показано далее, во многом определяют формирование нативных белковых структур. Однозначного определения водородной связи на сегодняшний день все еще не существует. В некоторых определениях за основу берется тот или иной экспериментальный признак (например, сдвиг полосы в ИК-спектре), в других перечисляются соответствующие функциональные группы, в третьих дается математическое или физическое описание картины образования Н-связи. Целям же нашего исследования наилучшим образом соответствует определение, данное в классической монографии Пиментела и Мак-Клеллана [41], которые употребляют термин Н-связь (или водородная связь) по отношению к взаимодействиям, удовлетворяющих следующим условиям: «Н-связь существует между функциональной группой А-Н и атомом или группой атомов В той же или другой молекулы, если: а) установлен факт образования связи (ассоциация или хелация), б) установлено, что в этой новой связи между А-Н и В особое участие принимает атом водорода, уже связанный с А». В соответствии с этим определением атом А является донором, а атом В акцептором водородной связи.
Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920 г., чтобы объяснить высокие температуры кипения воды, жидкого HF и некоторых других соединений. Водородные связи наблюдаются в тех случаях, когда атом Н несет большой положительный парциальный заряд, а его партнер по контакту - большой отрицательный парциальный заряд. Эти заряды притягиваются друг к другу. Поскольку электронное облако атома водорода сильно смещено к атому, с которым водород ковалентно связан, отталкивание оболочек контактирующих партнеров мало, и притяжение зарядов может их еще более сблизить. Такое короткое расстояние обуславливает большую величину кулоновской энергии притяжения, а также высокую дисперсионную энергию. Энергия взаимодействия имеет в этом случае значение, промежуточное по абсолютной величине между энергией вандерваальсовых контактов и энергией ковалентных связей. В составе водородной связи положительно заряженный Н-атом находится между двумя отрицательно заряженными атомами. Наиболее низким значением потенциальной энергии эта система обладает, если все три заряда лежат на одной прямой. Таким образом, именно геометрические параметры водородной связи определяют энергию этого типа взаимодействий. Электростатические расчеты показывают, что отклонение угла между связями донор-акцептор, донор-водород от нуля на 20 понижает энергию связи на 10%. Однако в реальных белках (парвальбумин и другие) среднее отклонение угла составляет именно 20. Очевидно в белковых структурах устанавливается определенный компромисс между максимальной энергией водородной связи и другими геометрическими ограничениями. Считается, что водородная связь существует, если расстояние между донором и акцептором не превышает 3,5 А, угол DAX при акцепторе больше 90 и угол отклонения водорода от прямой (угол HDA при доноре) не превышает 30 .Однако, эти ограничения не бесспорны, и их следует считать скорее ориентирами (рис. 1.12). Солевые мостики существуют между заряженными остатками и могут быть описаны как классическое кулоновское взаимодействие между двумя точечными зарядами.
Спрятанные гидрофильные остатки в белках как фактор, определяющий нативную упаковку спиралей
Как было сказано выше, существуют многочисленные свидетельства того, что именно спрятанные и полуспрятанные полярные остатки и взаимодействия между ними определяют упаковку а-спиралей в сс-белках. Как неоднократно было показано экспериментально, наличие полярной группы в гидрофобном кластере заставляет а-спирали искать такой способ упаковки, который позволяет спрятанному остатку завязать водородные связи внутри гидрофобного ядра (рис. 2.1) Чтобы проверить, может ли аналогичный механизм действовать в глобулярных белках, мы проанализировали выборку глобулярных белков, состоящих только из а-спиралей. Можно было бы считать доказанным, что спрятанные полярные остатки способны играть важную роль в отборе нативных упаковок а-спиралей и в глобулярных белках, если бы удалось показать, что: а) в глобулярных белках встречаются спрятанные полярные остатки; б) значительная часть этих остатков участвует в межспиральных полярных взаимодействиях; в) полярные остатки, погруженные в гидрофобное ядро, стремятся иметь насыщенную систему водородных связей. Нами была проанализирована выборка из 80 сс-спиральных белков. (Здесь и далее, трехмерные структуры брались из банка белковых структур PDB [91]). Доступная поверхность остатков анализировалась интерактивной программой ASC [92]. Боковая цепь гидрофильного остатка считалась полностью спрятанной, если доступная поверхность каждого из ее полярных атомов была не более 2 А (на самом деле, подавляющее большинство полярных атомов спрятанных боковых цепей вообще не имеет поверхности, доступной молекулам растворителя).
В настоящей работе рассматривались взаимодействия типа «боковая цепь- боковая цепь», «боковая цепь - основная цепь» и «боковая цепь - вода». Взаимодействия типа «боковая цепь - катион» не учитывались, и потому белки, содержащие атомы металлов не были включены в нашу базу данных. В принципе, между спрятанными боковыми цепями возможно образование ионных пар или солевых связей. Однако, определить в какой форме -заряженной или нейтральной - находится спрятанная боковая цепь, в большинстве случаев невозможно, так как с помощью ренгеноструктурного анализа атомы водорода в белках «не видны». Поэтому мы считали, что все спрятанные полярные боковые цепи находятся в нейтральной форме. Исходя из этого предположения, определяли число оптимальных водородных связей, которые образует каждая спрятанная боковая цепь с помощью программы WHATJF [93]. Так как эта программа рассматривает боковые цєпи Asp и Glu только в качестве акцепторов и не учитывает молекул воды, то расчет возможных дополнительных водородных связей для остатков Asp и Glu, а также между спрятанными боковыми цепями и молекулами воды проводился с помощью наших собственных программ на основании аналогичных критериев.
Перечень отобранных белков и доменов, а также частоты встречаемости в них спрятанных полярных боковых цепей представлены в таблице 1. Всего в 80 белках и доменах обнаружено 557 полярных боковых цепей, полностью недоступных молекулам растворителя; они принимают участие в образовании 1032 водородных связей. Из них 317 боковых цепей участвуют в межспиральных взаимодействиях, образуя 447 межспиральных водородных связей; 585 связей являются внутриспиральными или образуются с нерегулярными участками и молекулами связанной воды (из них с водой 162 связи). Как видно из таблицы 1, на одну молекулу белка (на один домен) приходится от 1-2 до 20 и более спрятанных полярных боковых цепей. Все эти данные свидетельствуют о том, что а) спрятанные полярные боковые цепи довольно широко распространены в а-спиральных белках и доменах, б) они участвуют в межспиральных взаимодействиях и, следовательно в) могут влиять на взаимное расположение или упаковку а-спиралей. Из таблицы 1 также следует, что чаще всего спрятанными в белках оказываются боковые цепи треонинов (всего 142 остатка), серинов (112) и тирозинов (96). Это можно объяснить, с одной стороны, относительно простым строением полярной группы этих боковых цепей. ОН- группа имеет линейное строение, может свободно вращаться вокруг одинарной связи С-О, имеет небольшой объем, то есть не создает особых стерических затруднений. С другой стороны, как видно на рисунке 2.2, этим боковым цепям во многих случаях достаточно образовать всего одну водородную связь, чтобы они могли погрузиться в гидрофобное окружение. Наконец, ОН- группа этих боковых цепей может и очень часто образует водородную связь с СО-группой основной цепи (см. табл. 2), то есть имеет в избытке возможных партнеров для образования связи. Теоретически ОН-группа боковых цепей треонина, серина и тирозина способна образовать три оптимальные водородные связи — одну в качестве донора и две в качестве акцептора. Гистограммы на рисунке 2.2 показывают, что в белках эти боковые цепи относительно редко образуют все три возможные водородные связи.
Моделирование «нативных» и «ненативных» межспиральных взаимодействий
Геометрия а-спирали является фактором, накладывающим жесткие ограничения на гидрофильные межспиральные взаимодействия. Как было показано выше, спирали могут упаковываться лишь ограниченным числом способов. Поэтому следующим шагом наших исследований стал стереохимический анализ гидрофильных взаимодействий в различных типах упаковок спиралей.
Для данной работы мы отобрали 120 негомологичных а-спиральных белков и доменов, структуры которых определены с разрешением до 2,5 А: lgrj, lsry, lcxz, lids, lbsn, Ia6m, lphn, la32, lesh, lad6, lb79, lbgf, ldd5, laue, His, 2spc, Iquu, lqoy, lbz4, lqsd, laul, lc02, lfio, 1е2а, lc8r, lffh, lfew, lbgl, ldbh, lal7, lhu3, lrop, lcun, lchu, 2tct, 2cbl, 2fha, lbay, lb8f, lclk, lbmO, Iddt, lmaz, Stln, ltx4, ldg3, lah7, lat5, laa7, lutg, lfkx(A), likx(C), lppr, leyv, lprg, lcol, Idle, ldvk, lelk, leyh, lpbv, 2ygs, luby, Hal, 2pgd, lbuc, lile, loxy, lmro, lrlr, lqaz, lflm, lhxl, 2ccy, Іебі, lfur, le2x, Ifkm, lfpo, ldd9, ldk8, lcb8, 2asr, IfDj, ldkz, lqla, lek9, lewq, lhel, 256b, 5eau, leex, lail, laqt, ldxr(L), lehk, lwer, lezf, lem9, lf6f, 2ilk, 2a0b, ldps, lhfB, ldvb, lhqo, lakO, lfx8, lmty(B), lmty(G), lqjb, 5csm, Ilia, 2mhr, lbmt, lei7, lytf(B), lytf(D), Ifm9,la26. Необходимая структурная структурная информация была получена из базы данных SCOP [95]. Для выявления возможной гомологии использовалась программа BLAST для попарного выравнивания [96]. Из данной выборки белков было отобрано 507 пар длинных (10 и более остатков) а-спиралей упакованных параллельно или антипараллельно, в которых угол О. между осями спиралей по модулю был меньше 40. При этом V-образные структуры, в которых а-спирали контактировали не по всей длине, отбраковывались. Углы между осями спиралей определялись с помощью программы WebMol [97].
Выборка сс-белков также формировалась с использованием базы данных SCOP. Поскольку белков этого класса сравнительно немного, мы включили в эту выборку также белки, структуры которых сделаны с более низким разрешением. В результате в выборку было включено 45 белков, из которых было отобрано 49 пар спиралей, упакованных параллельно и антипараллельно (таблица 3). При этом из гомотримеров, гомотетрамеров и гомопентамеров отбиралось только по одной паре взаимодействующих спиралей. Видно, что все проанализированные нами пары спиралей в сс белках имеют хотя бы один межспиральный солевой мостик или одну межспиральную водородную связь. Межспиральные водородные связи определялись с помощью программы WHAT_IF [93] Межспиральные солевые мостики определялись с помощью наших собственных программ. Считалось, что солевой мостик между разноименно заряженными полярными группами образован, если расстояние между каким-либо неводородным атомом одной группы и одним из атомов другой группы было меньше 4 А. При этом взаимодействия, учтенные программой WHAT_IF, вторично не рассматривались.
Общая картина межспиральных взаимодействий между различными полярными группами в сс-белках представлена на рис. 2.5а. Всего в 49 парах спиралей из этого структурного класса было найдено 265 межспиральных водородных и солевых связей. Из них 84% относятся к взаимодействиям типа «боковая цепь - боковая цепь», 16% к взаимодействиям типа «боковая цепь -основная цепь». Среди межспиральных взаимодействий «боковая цепь -основная цепь» встречаются только связи типа «донор боковой цепи -кислород основной цепи» и, по существу, нет связей акцепторов боковых цепей с атомами азота основной цепи. Это ожидаемо, поскольку во внутренних витках регулярных а-спиралей все NH-группы уже имеют по одному акцептору для образования водородных связей (и, обычно, это предел), а каждый атом кислорода основной цепи способен образовать еще одну водородную связь. Ожидаемым также является отсутствие взаимодействий между одноименно заряженными боковыми цепями (например, Lys-Arg, Lys-Lys, Asp-Glu и т. д.).
Анализ частот встречаемости связей между другими полярными группами позволяет проследить явную избирательность в этих взаимодействиях: одни пары «донор-акцептор» или «боковая цепь-боковая цепь» встречаются очень часто, другие - редко, третьи не встречаются совсем (рис. 2.5а). Высокая частота встречаемости пар Arg-GIu, Lys-Glu, His-Glu, Lys-Asp и Arg-Asp указывает на важную роль этих межспиральных взаимодействий в формировании структуры сс-белков. Эта закономерность хорошо известна в литературе и широко используется при моделировании и конструировании новых белков этого класса. Следует отметить, что большую часть межспиральных связей в сс-белках образуют между собой длинные боковые цепи (Arg, Lys, GIu, Gin, Туг), и совсем небольшой вклад вносят короткие боковые цепи серина и треонина. Среди незаряженных боковых цепей отметим большой вклад в межспиральные взаимодействия остатков аспарагина и глутамина, а также неожиданно высокую частоту встречаемости пар Tyr-Glu и Tyr-Gln.
На рисунке 2.56 представлена общая картина межспиральных взаимодействий в глобулярных белках. Для анализа было отобрано 507 параллельно и антипараллельно упакованных пар спиралей из 120 глобулярных белков. Межспиральные водородные связи и солевые мостики были обнаружены в 336 парах (66%). Отметим, что пары спиралей, упакованные без образования межпиральных связей, образованы, как правило, более короткими спиралями. Всего было найдено 813 межспиральных водородных связей и солевых мостиков.